1. QUEM. QUEM | Sobrepeso e obesidade. www.who.int/gho/ncd/
risk_factors / overweight / en / index.html. Acessado 29 janeiro 2015.
2. Visscher PM, Marrom MA, McCarthy MI, Yang J. Cinco anos de descoberta do GWAS.
Am J Hum Genet. 2012; 90: 7 24.
3. Locke AE, Kahali B, Berndt SI, Justice AE, Pers. TH, Dia FR, et al. Genético
estudos do índice de massa corporal rendem novos insights para a biologia da obesidade. Natureza.
2015; 518: 197 206.
4. Ling C, Del Guerra S, Lupi R, R nn T, Granhall C, Luthman H, et al.
Regulação epigenética de PPARGC1A em ilhotas diabéticas tipo 2 humanas e
efeito na secreção de insulina. Diabetologia. 2008; 51: 615 22.
5. Van Dijk SJ, Molloy PL, Varinli H. Morrison JL, Muhlhausler BS. Epigenética
e obesidade humana. Int J Obes (Lond). 2015; 39: 85 97.
6. O AL, o Pan H, o Chen L, o Ong ML, o Dogra S, o Wong J, e outros. O efeito de
genótipo e ambiente intraútero na variação interindividual em recém-nascidos
Metilomas de DNA. Genome Res. 2014; 24: 1064 74.
7. Olsson AH, Volkov P, K Bacos, Dayeh T, Hall E, Nilsson EA, et al. Genoma
associações entre influência genética e variação epigenética
Expressão de mRNA e secreção de insulina em ilhotas pancreáticas humanas. PLoS
Genet 2014; 10: e1004735.
8. Grundberg E, Meduri E, JK Sandling, AK Hedman, Keildson S, Buil A, et al.
Análise global da variação da metilação do DNA no tecido adiposo de gêmeos
revela ligações com variantes associadas à doença em elementos reguladores distais.
Am J Hum Genet. 2013; 93: 876 90.
9. Ronn T, Volkov P, L Gillberg, Kokosar M, Perfilyev A, Jacobsen AL, et al.
Impacto da idade, IMC e níveis de HbA1c no DNA genômico
Metilação e padrões de expressão de RNAm em tecido adiposo humano
e identificação de biomarcadores epigenéticos no sangue. Hum Mol Genet.
2015; 24: 3792 813.
10. Waterland RA, Michels, KB. Epidemiologia epidemiológica do desenvolvimento
hipótese das origens. Annu Rev Nutr. 2007; 27: 363 88.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, SM MacLaughlin, Gentili
S et ai. As origens precoces da obesidade tardia: vias e mecanismos. Adv
Exp Med Biol. 2009; 646: 71 81.
12. Ravelli A, van der Meulen J, R Michels, Osmond C, Barker D, Hales C, et al.
Tolerância à glicose em adultos após exposição pré-natal à fome. Lanceta.
1998; 351: 173 7.
13. McMillen IC, MacLaughlin SM, BS Muhlhausler, Gentili S, Duffield JL,
Morrison JL. Origem do desenvolvimento da saúde e doença do adulto: o papel dos
nutrição periconcepcional e fetal. Basic Pharmacol Toxicol.
2008; 102: 82 9.
14. Zhang S, Rattanatray L, MC McMillen, Suter CM, Morrison JL. Periconcepcional
nutrição e programação precoce de uma vida de obesidade ou adversidade. Prog
Biophys Mol Biol. 2011; 106: 307 14.
15. Bouret S, Levin BE, Ozanne SE. Controle de interações gene-ambiente
homeostase da energia e glicose e as origens desenvolvimentais da obesidade.
Physiol Rev. 2015; 95: 47 82.
16. Borengasser SJ, Y Zhong, Kang P, F Lindsey, Ronis MJ, Texugo TM, et al.
A obesidade materna aumenta a diferenciação do tecido adiposo branco e altera
metilação do DNA em escala genômica em filhotes de ratos machos. Endocrinologia.
2013; 154: 4113 25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
et al. A plasticidade metabólica durante o desenvolvimento dos mamíferos é direcional
dependente do estado nutricional precoce. Proc Natl Acad Sci EUA A.
2007; 104: 12796 800.
18. Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C,
et al. A metilação do promotor do gene epigenético no nascimento está associada
a adiposidade posterior da criança. Diabetes. 2011; 60: 1528 34.
19. McMillen IC, Adam CL e Muhlhausler BS. Origens precoces da obesidade:
programação do sistema regulatório do apetite. J Physiol. 2005; 565 (Pt 1): 9 17.
20. Begum G, Stevens A, Smith EB, K Connor, Challis JR, Bloomfield F, et al.
Alterações epigenéticas nas vias reguladoras da energia hipotalâmica fetal são
associada à desnutrição e geminação materna. FASEB J.
2012; 26: 1694 703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY, et al. Obesidade materna
e diabetes podem causar alteração da metilação do DNA nos espermatozóides
prole em ratos. Reprod Biol Endocrinol. 2014; 12: 29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, J Averous, Bruhat A, et al.
A desnutrição perinatal afeta a metilação e a expressão da leptina
gene em adultos: implicação para o entendimento da síndrome metabólica.
FASEB J. 2011; 25: 3271 8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, et al.
Dieta materna durante a gravidez induz expressão gênica e DNA
alterações de metilação em tecidos fetais em ovelhas. Frente Genet. 2013; 4: 49.
24. Li CC, Young PE, CA Maloney, Eaton SA, Cowley MJ, Buckland ME, et al.
Obesidade materna e diabetes induzem defeitos metabólicos latentes e
alterações epigenéticas generalizadas em camundongos isogênicos. Epigenética. 2013; 8: 602 11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Proteína dietética
restrição de ratas prenhes induz e suplementação com ácido fólico impede
modificação epigenética da expressão gênica hepática na prole. J Nutr.
2005; 135: 1382 6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, et al. No utero
efeitos. A subnutrição in utero perturba o metiloma do espermatozóide adulto
e metabolismo intergeracional. Ciência. 2014; 345 (80): 1255903.
27. Suter M, Bocock P, L Showalter, Hu M, Shope C, R McKnight, et al.
Epigenômica: exposição materna à dieta rica em gordura no útero interrompe
expressão gênica periférica circadiana em primatas não humanos. FASEB J.
2011; 25: 714 26.
28. Suter MA, Ma J, PM Vuguin, Hartil K, Fiallo A, RA Harris, et al. No utero
A exposição a uma dieta hiperlipídica materna altera o código da histona epigenética em um
modelo murino. Am J Obs Gynecol. 2014; 210: 463 e1 463 e11.
29. Tosh DN, Fu Q, Callaway CW, RA McKnight, McMillen IC, Ross MG, et al.
Epigenética da obesidade programada: alteração no gene IFFR hepático IGF1
Expressão de mRNA e estrutura de histonas em pós-parto rápido versus tardio
crescimento de recuperação. Sou J Physiol Gastrointest Liver Physiol.
2010; 299: G1023 9.
30. Sandovici I, Smith NH, Dr. Nitert, Ackers-Johnson M., Uribe-Lewis S, Ito Y,
et al. Dieta materna e envelhecimento alteram o controle epigenético de um promotor
interação no gene Hnf4a em ilhotas pancreáticas de ratos. Proc Natl
Acad Sci US A. 2011; 108: 5449 54.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Investigações em
resposta epigenética transgeracional ao longo da linhagem masculina em suínos F2. PLoS
1. 2012; 7, e30583.
32. Carone BR, Fauquier L., Habib N, Shea JM, Hart CE, Li R, et al. Paternalmente
induziu a reprogramação ambiental transgeracional do metabolismo
expressão gênica em mamíferos. Célula. 2010; 143: 1084 96.
33. Ost A, Lempradl A, Casas E, Weigert M. Tiko T, Deniz M. et al. Dieta paterna
define estado da cromatina da prole e obesidade intergeracional. Célula.
2014; 159: 1352 64.
34. Mart nez D, Pentinat T, Rib S, Daviaud C, Bloks VW, Cebri J, et al. No utero
desnutrição em camundongos machos programa metabolismo lipídico hepático na segunda geração
descendentes envolvendo alteração de metilação do DNA Lxra. Cell Metab.
2014; 19: 941 51.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H, et al. Paternalmente
induziu a herança transgeracional da suscetibilidade ao diabetes em
mamíferos. Proc Natl Acad Sci US A. 2014; 111: 1873 8.
36. Grossniklaus U, Kelly WG, Kelly B, AC Ferguson-Smith, Pembrey M, Lindquist
S. Herança epigenética transgeracional: qual a importância disso? Nat Rev
Genet. 2013; 14: 228 35.
37. Pembrey M, Saffery R, Bygren LO. Respostas transgeracionais humanas ao
experiência na primeira infância: impacto potencial no desenvolvimento, saúde e
pesquisa biomédica. J Med Genet. 2014; 51: 563 72.
38. Wolff GL, Kodell RL, SR Moore, Cooney CA. Epigenética materna e metila
suplementos afetam a expressão do gene agouti em camundongos Avy / a. FASEB J.
1998; 12: 949 57.
39. Jirtle RL, Skinner MK. Epigenômica ambiental e suscetibilidade a doenças.
Nat Rev Genet. 2007; 8: 253 62.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Herança epigenética em
o locus agouti no mouse. Nat Genet. 1999; 23: 314 8.
41. Cropley JE, CM Suter, Beckman KB, Martin DI. Linhagem germinativa epigenética
modificação do alelo murino A vy por suplementação nutricional. Proc
Natl Acad Sci US A. 2006; 103: 17308 12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Proteína dietética
restrição durante a gravidez F0 em ratos induz alterações transgeracionais em
o transcriptoma hepático na prole feminina. PLoS One. 2011; 6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P, e outros. Mousehuman
análise epigenética experimental desmascara alvos alimentares e
responsabilidade genética para fenótipos diabéticos. Cell Metab. 2015; 21: 138 49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, et al.
Recomendações para o desenho e análise de todo o epigenoma
estudos de associação. Métodos Nat. 2013; 10: 949 55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, R nn T, Ling C. Identificação de
CpG-SNPs associados ao diabetes tipo 2 e metilação diferencial do DNA
em ilhotas pancreáticas humanas. Diabetologia. 2013; 56: 1036 46.
46. Relton CL, Davey Smith G. randomização mendeliana epigenética em duas etapas: a
estratégia para estabelecer o papel causal dos processos epigenéticos nas vias
à doença. Int J Epidemiol. 2012; 41: 161 76.
47. Liu Y, Aryee MJ, Padyukov L, MD Fallin, Hesselberg E, Runarsson A, et al.
Dados de associação ampla do epigenoma implicam a metilação do DNA como
intermediário de risco genético na artrite reumatóide. Nat Biotechnol.
2013; 31: 142 7.
48. Yuan W, Xia Y, Bell CG, ainda eu, Ferreira T, Ward KJ, et al. Um Integrado
Análise epigenômica para loci de suscetibilidade ao diabetes do tipo 2 em monozigóticos
gêmeos. Nat Commun. 2014; 5: 5719.
49. Nitert MD, T Dayeh, Volkov P, T Elgzyri, Hall E, Nilsson E, et al. Impacto de um
intervenção de exercício na metilação do DNA no músculo esquelético de primeiro grau
parentes de pacientes com diabetes tipo 2. Diabetes. 2012; 61: 3322 32.
50. Gagnon F, A ssi D, Carri A, Morange PE, Tr gou t DA. Validação robusta de
associação dos níveis de metilação no lócus de CPT1A com níveis plasmáticos lipídicos.
J Lipid Res. 2014; 55: 1189 91.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
et al. Estudo de associação ampla do epigenoma (EWAS) do IMC, alteração do IMC e
circunferência da cintura em adultos afro-americanos identifica múltiplos replicados
loci. Hum Mol Genet. 2015: ddv161 .
52. Dick KJ, Nelson CP, Tsaprouni L., Sandling JK, A ssi D, Wahl S, et al. DNA
metilação e índice de massa corporal: uma análise genômica ampla. Lanceta.
2014; 6736: 1 9.
53. Su S, Zhu H, Xu X, X Wang, Dong Y, Kapuku G, et al. Metilação do DNA de
o gene LY86 está associado à obesidade, resistência à insulina e
inflamação. Twin Res Hum Genet. 2014; 17: 183 91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, et al.
PGC1? metilação do promotor no sangue em 5 7 anos prediz adiposidade de
9 a 14 anos (EarlyBird 50). Diabetes. 2014; 63: 2528 37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, et al.
Metilação do DNA promotor do gene ADRB3 no sangue e tecido adiposo visceral
tecido está associado a distúrbios metabólicos em homens. Epigenômica.
2014; 6: 33 43.
56. Agha G, Houseman EA, Kelsey KT, CB Eaton, Buka SL, Loucks EB. A adiposidade é
associado ao perfil de metilação do DNA no tecido adiposo. Int J Epidemiol.
2014: 1 11.
57. Irvin MR, Zhi D., Joehanes R, Mendelson M., Aslibekyan S, Claas SA, et al.
Estudo de associação do epigenome-wide de lipídios de sangue de jejum na genética de
drogas hipolipemiantes e estudo da rede de dieta. Circulação. 2014; 130: 565 72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY, et al.
A metilação no locus CPT1A está associada à subfração de lipoproteínas
perfis. J Lipid Res. 2014; 55: 1324 30.
59. Pfeifferm L, Wahl S, LC de Pilling, Reischl E, Sandling JK, Kunze S, e outros. DNA
A metilação de genes relacionados a lipídios afeta os níveis de lipídios no sangue. Circ Cardiovasc
Genet 2015.
60. Petersen AK, Zeilinger S, Kastenm ller G, R misch-Margl W, Brugger M, Peters
A, et al. A epigenética encontra a metabolômica: uma associação ampla do epigenoma
estudo com características metabólicas do soro sanguíneo. Hum Mol Genet. 2014; 23: 534 45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D, et al. Epigenomewide
estudo de associação de medidas de jejum de glicose, insulina e HOMA-IR
na genética de drogas hipolipemiantes e estudo da rede de dieta. Diabetes.
2014; 63: 801 7.
62. Dayeh T, Volkov P, Sal S, Hall E, Nilsson E, Olsson AH, et al. Em todo o genoma
Análise de metilação do DNA de ilhotas pancreáticas humanas do tipo diabético 2
e doadores não diabéticos identificam genes candidatos que influenciam a insulina
secreção. PLoS Genet. 2014; 10, e1004160.
63. Nilsson E, PA de Jansson, Perfilyev A, Volkov P, Pedersen M, Svensson MK, e outros.
Metilação alterada de DNA e expressão diferencial de genes que influenciam
metabolismo e inflamação no tecido adiposo de indivíduos do tipo 2
diabetes. Diabetes. 2014; 63: 2962 76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes, MT, Lea RA, et al. Uma análise da metilação do DNA no tecido adiposo humano revela a modificação diferencial dos genes da obesidade antes e depois do bypass gástrico e do peso
perda. Gene. 2015; 16: 1 21.
65. Bateson P, Gluckman P. Plasticidade e robustez no desenvolvimento e
evolução. Int J Epidemiol. 2012; 41: 219 23.
66. Feinberg AP, Irizarry RA, Feinberg AP, IR Irritry. Evolução em saúde e
medicina Sackler colloquium: variação epigenética estocástica como condução
força de desenvolvimento, adaptação evolutiva e doença. Proc Natl Acad
Sci US A. 2010; 107 (Supl): 1757 64.
67. Martino D, Loke YJ, Gordon L., Ollikainen M, Cruickshank MN, Saffery R, et al.
Análise longitudinal e genômica da metilação do DNA em gêmeos desde o nascimento
para 18 meses de idade revela mudança epigenética rápida no início da vida e pares específicos
efeitos de discordância. Genoma Biol. 2013; 14: R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y, et al. DNA
assinaturas de metilação ligam a exposição à fome pré-natal ao crescimento e
metabolismo. Nat Commun. 2014; 5: 5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA, et al.
Nutrição materna na concepção modula a metilação do DNA de humanos
epialelos metastáveis. Nat Commun. 2014; 5: 3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, et al.
Impacto nos padrões de metilação da criança com diabetes gestacional materno
mellitus e restrição de crescimento intra-uterino sugerem genes e
vias associadas ao risco subsequente de diabetes tipo 2. FASEB J. 2014: 1 12.
71. Morales E, Noivo A, Lawlor DA, Relton CL. Assinaturas de metilação do DNA em
sangue do cordão umbilical associado ao ganho de peso gestacional materno: resultados de
o grupo ALSPAC. Notas Res do BMC. 2014; 7: 278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, et al.
Diabetes mellitus gestacional epigeneticamente afeta genes predominantemente
envolvidos em doenças metabólicas. Epigenética. 2013; 8: 935 43.
73. Liu X, Chen Q, Hai Tsai, Wang G, X Hong, Zhou Y, et al. Materno
preconceito índice de massa corporal e DNA do sangue do cordão prole
metilação: exploração das origens da doença no início da vida. Environ Mol
Mutagênico. 2014; 55: 223 30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF, et al.
Recém-nascidos de pais obesos alteraram os padrões de metilação do DNA em
genes impressos. Int J Obes (Lond). 2015; 39: 650 7.
75. Jacobsen SC, Br ns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, et al.
Efeitos da sobrealimentação de alto teor de gordura a curto prazo no DNA genômico
metilação no músculo esquelético de homens jovens saudáveis. Diabetologia.
2012; 55: 3341 9.
76. Gillberg L, Jacobsen SC, R nn T, Br ns C, Vaag A. PPARGC1A DNA
metilação no tecido adiposo subcutâneo em indivíduos com baixo peso ao nascer
impacto de 5 dias de superalimentação com alto teor de gordura. Metabolismo. 2014; 63: 263 71.
77. Huang YT, Maccani JZJ, Hawley NL, Ala RR, Kelsey KT, McCaffery JM.
Padrões epigenéticos em mantenedores de perda de peso bem sucedidos: um estudo piloto. Int J
Obes (Lond). 2015; 39: 865 8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N slund E,
Zierath JR. Perda de peso após cirurgia de bypass gástrico na obesidade humana
remodela a metilação do promotor. Cell Rep. 2013: 1 8.
79. Ahrens M, Ammerpohl O, von Sch nfels W, Kolarova J, Bens S, Itzel T, et al.
A análise de metilação do DNA na doença hepática gordurosa não alcoólica sugere
assinaturas distintas específicas da doença e remodelação após cirurgia bariátrica.
Cell Metab. 2013; 18: 296 302.
80. Voisin S, Eynon N, Yan X, Bispo DJ. Treinamento físico e metilação do DNA
em humanos. Acta Physiol (Oxf). 2014; 213: 39 59.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekstr m TJ,
Tegn r J, et al. Uma análise integrativa revela uma reprogramação coordenada
do epigenoma e do transcriptoma no músculo esquelético humano após
Treinamento. Epigenética. 2014; 9: 1557 69.
82. Denham J, O Brien BJ, Marques FZ, Charchar FJ. Mudanças no leucócito
metilome e seu efeito sobre genes relacionados cardiovascular após o exercício.
J Appl Physiol. 2014: jap.00878.2014.
83. Rowlands DS, Página RA, Sukala WR, Giri M., Ghimbovschi SD, Hayat I, et al.
Redes integradas multi-omicas conectam metilação do DNA e miRNA com
plasticidade do músculo esquelético ao exercício crônico na obesidade diabética do tipo 2.
Physiol Genomics. 2014; 46: 747 65.
84. Horvath S, W Erhart, Brosch M, O Ammerpohl, von Schonfels W, Ahrens M,
et al. A obesidade acelera o envelhecimento epigenético do fígado humano. Proc Natl Acad
Sci. 2014; 111: 15538 43.
85. Alm n MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
A análise genômica ampla revela marcadores de metilação do DNA que variam com
idade e obesidade. Gene. 2014.; 548: 61 7
86. Houseman EA, Molitor J, Marsit CJ. Ajustes de mistura de células sem referência
na análise dos dados de metilação do DNA. Bioinformática. 2014; 30: 1431 9.
87. Wells JC. Uma avaliação crítica da hipótese de resposta adaptativa preditiva.
Int J Epidemiol. 2012; 41: 229 35.
88. Williams-Wyss O, Zhang S, SM MacLaughlin, Kleemann D, Walker SK, Suter
CM et al. Número de embriões e desnutrição periconcepcional no
ovelhas têm efeitos diferenciais no epigenótipo, crescimento e
desenvolvimento. Am J Physiol Endocrinol Metab. 2014; 307: E141 50.
89. Zhang S, L de Rattanatray, Morrison JL, Nicholas LM, mentira S, McMillen IC.
Obesidade materna e as origens precoces da obesidade infantil: pesando
os benefícios e custos da perda de peso materna no período periconcepcional
período para a prole. Exp Diabetes Res. 2011; 2011: 585749.
90. Zhang S, Williams-Wyss O, SM MacLaughlin, Walker SK, Kleemann DO, Suter
CM et al. Subnutrição materna durante a primeira semana após a concepção
resulta na diminuição da expressão do receptor de glicocorticoide mRNA no
ausência de hipermetilação do exon 17 em GR na hipófise fetal tardia
gestação. J Dev Orig Heal Dis. 2013; 4: 391 401.
91. Lie S, Morrison JL, Williams-Wyss O, CM Suter, Humphreys DT, Ozanne SE,
et al. Desnutrição periconcepcional programa mudanças na sinalização de insulina
moléculas e microRNAs no músculo esquelético em singleton e twin fetal
ovelha. Biol Reprod. 2014; 90: 5.
92. Van Straten EM, van Meer H, Huijkman NC, van Dijk TH, Baller JF, Verkade
HJ et al. A ativação do receptor X do fígado fetal induz agudamente a lipogênese, mas
não afeta a resposta lipídica plasmática a uma dieta rica em gordura em camundongos adultos. Sou J
Physiol Endocrinol Metab. 2009; 297: E1171 8.
93. Fernandez-Twinn DS, Alfaradhi MZ, Martin-Gronert MS, Duque-Guimarães
DE, Piekarz A, Ferland-McCollough D, et al. Downregulation de IRS-1 em
tecido adiposo da prole de camundongos obesos é programado de forma autônoma
através de mecanismos pós-transcrição. Mol Metab.
2014; 3: 325 33.
94. RA Waterland, Travisano M, Tahiliani KG. Hipermetilação induzida por dieta em
O amarelo não é herdado transgeracionalmente através da fêmea.
FASEB J. 2007; 21: 3380 5.
95. Ge ZJ, Luo SM, Lin F, Qiang Liang, Huang L, Wei YC, et al. Metilação do DNA em
ovócitos e fígado de camundongos fêmeas e seus descendentes: efeitos da dieta com alto teor de gordura induzida
obesidade. Env Heal Perspect. 2014; 122: 159 64.
96. Ollikainen M, Ismail K, Gervin K, Kyll nen A, Hakkarainen A, Lundbom J, et al.
Alterações na metilação do DNA sanguíneo em todo o genoma em elementos regulatórios
e regiões heterocromáticas em gêmeos monozigóticos discordantes para obesidade
e gordura do fígado. Clin Epigenetics. 2015; 7: 1 13.








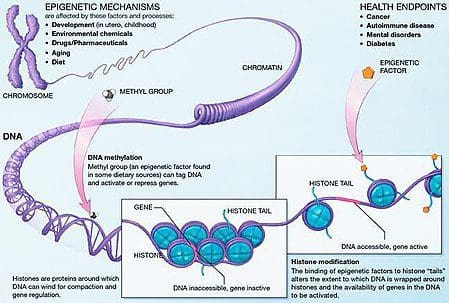 A obesidade é uma doença complexa multifatorial e uma melhor compreensão dos mecanismos subjacentes às interações entre estilo de vida, meio ambiente e genética é fundamental para o desenvolvimento de estratégias efetivas de prevenção e tratamento [1].
A obesidade é uma doença complexa multifatorial e uma melhor compreensão dos mecanismos subjacentes às interações entre estilo de vida, meio ambiente e genética é fundamental para o desenvolvimento de estratégias efetivas de prevenção e tratamento [1]. Os modelos animais fornecem oportunidades únicas para estudos altamente controlados que fornecem uma visão mecanicista sobre o papel de marcas epigenéticas específicas, tanto como indicadores do estado metabólico atual quanto como preditores do risco futuro de obesidade e doença metabólica. Um aspecto particularmente importante dos estudos com animais é que eles permitem a avaliação das alterações epigenéticas nos tecidos-alvo, incluindo o fígado e o hipotálamo, o que é muito mais difícil em humanos. Além disso, a capacidade de colher grandes quantidades de tecido fresco torna possível avaliar várias marcas de cromatina, bem como a metilação do DNA. Algumas dessas modificações epigenéticas, sozinhas ou em combinação, podem responder à programação ambiental. Em modelos animais, também é possível estudar várias gerações de descendentes e, assim, permitir a diferenciação entre a transmissão transgeracional e intergeracional do risco de obesidade mediada pela memória epigenética do estado nutricional dos pais, que não pode ser facilmente distinguida em estudos humanos. Usamos o primeiro termo para transmissão meiótica de risco na ausência de exposição contínua, enquanto o último envolve principalmente a transmissão direta de risco por meio da reprogramação metabólica do feto ou gametas.
Os modelos animais fornecem oportunidades únicas para estudos altamente controlados que fornecem uma visão mecanicista sobre o papel de marcas epigenéticas específicas, tanto como indicadores do estado metabólico atual quanto como preditores do risco futuro de obesidade e doença metabólica. Um aspecto particularmente importante dos estudos com animais é que eles permitem a avaliação das alterações epigenéticas nos tecidos-alvo, incluindo o fígado e o hipotálamo, o que é muito mais difícil em humanos. Além disso, a capacidade de colher grandes quantidades de tecido fresco torna possível avaliar várias marcas de cromatina, bem como a metilação do DNA. Algumas dessas modificações epigenéticas, sozinhas ou em combinação, podem responder à programação ambiental. Em modelos animais, também é possível estudar várias gerações de descendentes e, assim, permitir a diferenciação entre a transmissão transgeracional e intergeracional do risco de obesidade mediada pela memória epigenética do estado nutricional dos pais, que não pode ser facilmente distinguida em estudos humanos. Usamos o primeiro termo para transmissão meiótica de risco na ausência de exposição contínua, enquanto o último envolve principalmente a transmissão direta de risco por meio da reprogramação metabólica do feto ou gametas.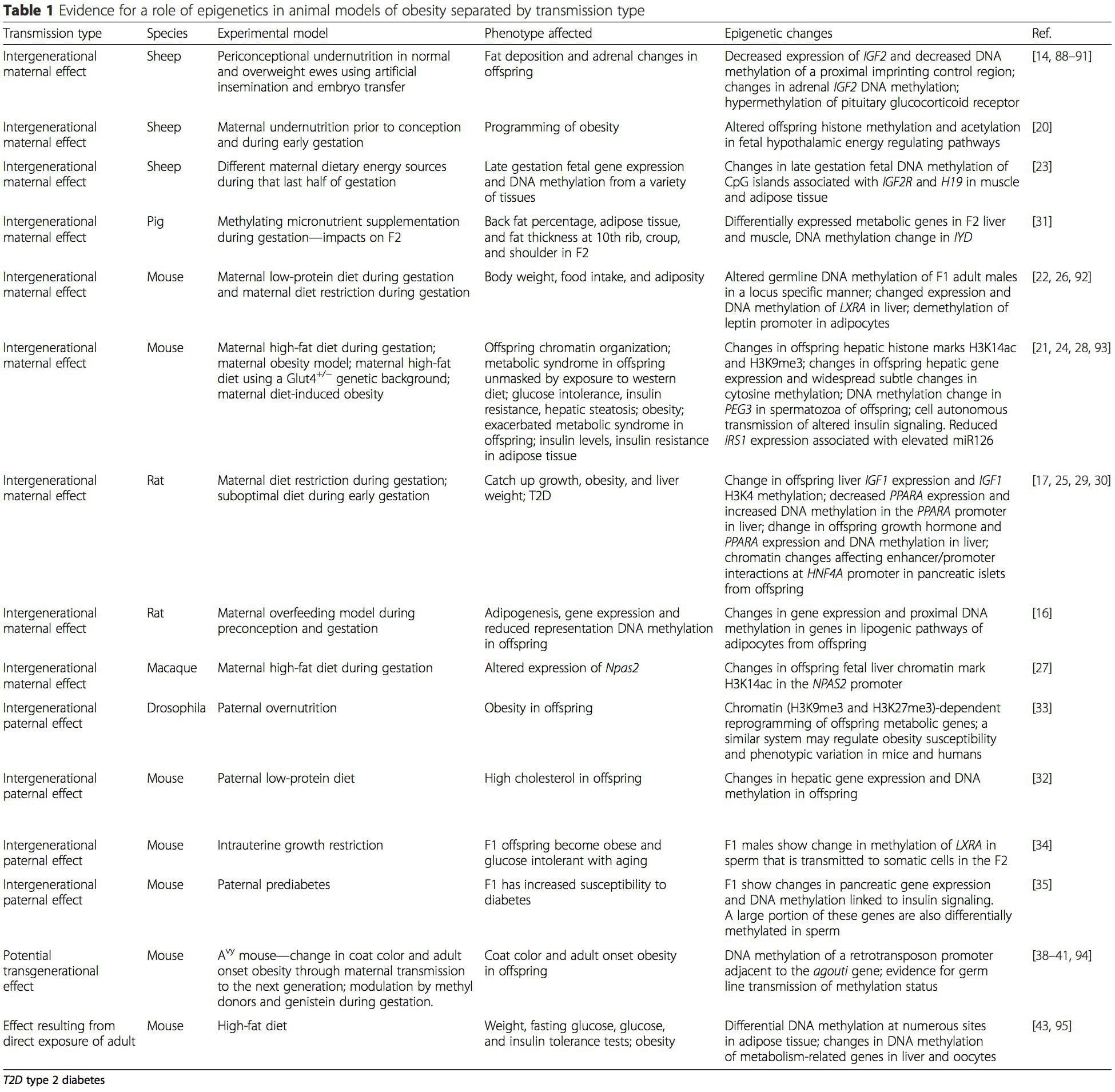 (i) Mudanças epigenéticas na prole associada à nutrição materna durante a gestação
(i) Mudanças epigenéticas na prole associada à nutrição materna durante a gestação Suplementação nutricional materna, desnutrição e supernutrição durante a gravidez podem alterar a deposição de gordura e a homeostase energética na prole [11, 13–15, 19]. Associados a esses efeitos na prole estão as mudanças na metilação do DNA, modificações pós-tradução de histonas e expressão gênica para vários genes-alvo, especialmente genes que regulam o metabolismo dos ácidos graxos e a sinalização da insulina [16, 17, 20 30]. A diversidade de modelos animais usados nesses estudos e as vias metabólicas comuns impactadas sugerem uma resposta adaptativa conservada evolutivamente, mediada por modificação epigenética. No entanto, poucos dos genes específicos identificados e alterações epigenéticas foram validados em estudos relacionados, e as investigações em larga escala do genoma normalmente não foram aplicadas. Um grande obstáculo à comparação desses estudos são as diferentes janelas mentais de desenvolvimento submetidas a desafios nutricionais, que podem causar desfechos consideravelmente diferentes. A prova de que as mudanças epigenéticas são causais, em vez de estarem associadas a mudanças fenotípicas na prole, também é necessária. Isso exigirá a identificação de uma resposta epigenética de memória epigenética dos pais induzida nutricionalmente que precede o desenvolvimento do fenótipo alterado na prole.
Suplementação nutricional materna, desnutrição e supernutrição durante a gravidez podem alterar a deposição de gordura e a homeostase energética na prole [11, 13–15, 19]. Associados a esses efeitos na prole estão as mudanças na metilação do DNA, modificações pós-tradução de histonas e expressão gênica para vários genes-alvo, especialmente genes que regulam o metabolismo dos ácidos graxos e a sinalização da insulina [16, 17, 20 30]. A diversidade de modelos animais usados nesses estudos e as vias metabólicas comuns impactadas sugerem uma resposta adaptativa conservada evolutivamente, mediada por modificação epigenética. No entanto, poucos dos genes específicos identificados e alterações epigenéticas foram validados em estudos relacionados, e as investigações em larga escala do genoma normalmente não foram aplicadas. Um grande obstáculo à comparação desses estudos são as diferentes janelas mentais de desenvolvimento submetidas a desafios nutricionais, que podem causar desfechos consideravelmente diferentes. A prova de que as mudanças epigenéticas são causais, em vez de estarem associadas a mudanças fenotípicas na prole, também é necessária. Isso exigirá a identificação de uma resposta epigenética de memória epigenética dos pais induzida nutricionalmente que precede o desenvolvimento do fenótipo alterado na prole. Estudos recentes demonstraram que o plano nutricional paterno pode impactar a deposição de gordura na prole e as marcas epigenéticas [31-34]. Uma investigação recente usando camundongos demonstrou que o pré-diabetes paterno leva ao aumento da suscetibilidade ao diabetes na prole F1 com alterações associadas na expressão do gene pancreático e metilação do DNA ligada à sinalização da insulina [35]. É importante ressaltar que houve uma sobreposição dessas alterações epigenéticas nas ilhotas pancreáticas e espermatozóides, sugerindo herança da linha germinativa. No entanto, a maioria desses estudos, embora intrigantes em suas implicações, são limitados na escala genômica de investigação e freqüentemente mostram alterações epigenéticas fracas e um tanto transitórias associadas a fenótipos metabólicos leves na prole.
Estudos recentes demonstraram que o plano nutricional paterno pode impactar a deposição de gordura na prole e as marcas epigenéticas [31-34]. Uma investigação recente usando camundongos demonstrou que o pré-diabetes paterno leva ao aumento da suscetibilidade ao diabetes na prole F1 com alterações associadas na expressão do gene pancreático e metilação do DNA ligada à sinalização da insulina [35]. É importante ressaltar que houve uma sobreposição dessas alterações epigenéticas nas ilhotas pancreáticas e espermatozóides, sugerindo herança da linha germinativa. No entanto, a maioria desses estudos, embora intrigantes em suas implicações, são limitados na escala genômica de investigação e freqüentemente mostram alterações epigenéticas fracas e um tanto transitórias associadas a fenótipos metabólicos leves na prole.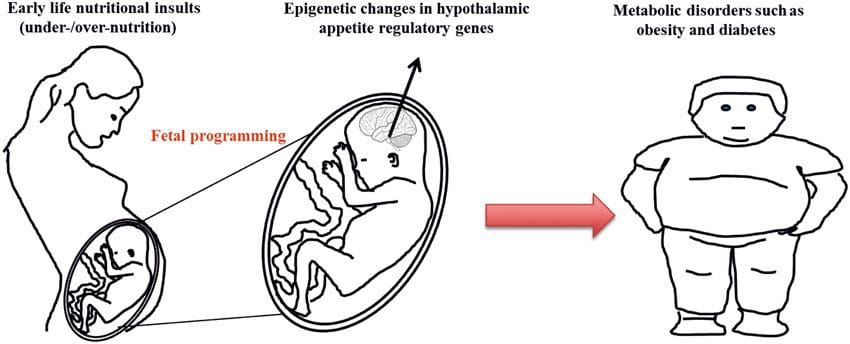 A transmissão estável de informações epigenéticas em múltiplas gerações é bem descrita em sistemas de plantas e C. elegans, mas seu significado em mamíferos ainda é muito debatido [36, 37]. Uma base epigenética para a transmissão de fenótipos pelos avós em resposta a exposições dietéticas foi bem estabelecida, incluindo em espécies de gado [31]. Os estudos mais influentes que demonstram os efeitos da transmissão epigenética impactando o fenótipo da prole têm usado o exemplo do camundongo agouti amarelo viável (Avy) [38]. Neste camundongo, a inserção de um retrotransposon a montante do gene agouti causa sua expressão constitutiva e conseqüente coloração amarela da pelagem e início da obesidade na idade adulta. A transmissão materna através da linha germinal resulta no silenciamento da expressão de agouti mediado pela metilação do DNA, resultando na cor da pelagem do tipo selvagem e fenótipo magro da prole [39, 40]. É importante ressaltar que estudos subsequentes com esses ratos demonstraram que a exposição materna a doadores de metila causa uma mudança na cor da pelagem [41]. Um estudo relatou a transmissão de um fenótipo para a geração F3 e alterações na expressão de grande número de genes em resposta à restrição proteica em F0 [42]; no entanto, as alterações na expressão foram altamente variáveis e uma ligação direta com as alterações epigenéticas não foi identificada neste sistema.
A transmissão estável de informações epigenéticas em múltiplas gerações é bem descrita em sistemas de plantas e C. elegans, mas seu significado em mamíferos ainda é muito debatido [36, 37]. Uma base epigenética para a transmissão de fenótipos pelos avós em resposta a exposições dietéticas foi bem estabelecida, incluindo em espécies de gado [31]. Os estudos mais influentes que demonstram os efeitos da transmissão epigenética impactando o fenótipo da prole têm usado o exemplo do camundongo agouti amarelo viável (Avy) [38]. Neste camundongo, a inserção de um retrotransposon a montante do gene agouti causa sua expressão constitutiva e conseqüente coloração amarela da pelagem e início da obesidade na idade adulta. A transmissão materna através da linha germinal resulta no silenciamento da expressão de agouti mediado pela metilação do DNA, resultando na cor da pelagem do tipo selvagem e fenótipo magro da prole [39, 40]. É importante ressaltar que estudos subsequentes com esses ratos demonstraram que a exposição materna a doadores de metila causa uma mudança na cor da pelagem [41]. Um estudo relatou a transmissão de um fenótipo para a geração F3 e alterações na expressão de grande número de genes em resposta à restrição proteica em F0 [42]; no entanto, as alterações na expressão foram altamente variáveis e uma ligação direta com as alterações epigenéticas não foi identificada neste sistema.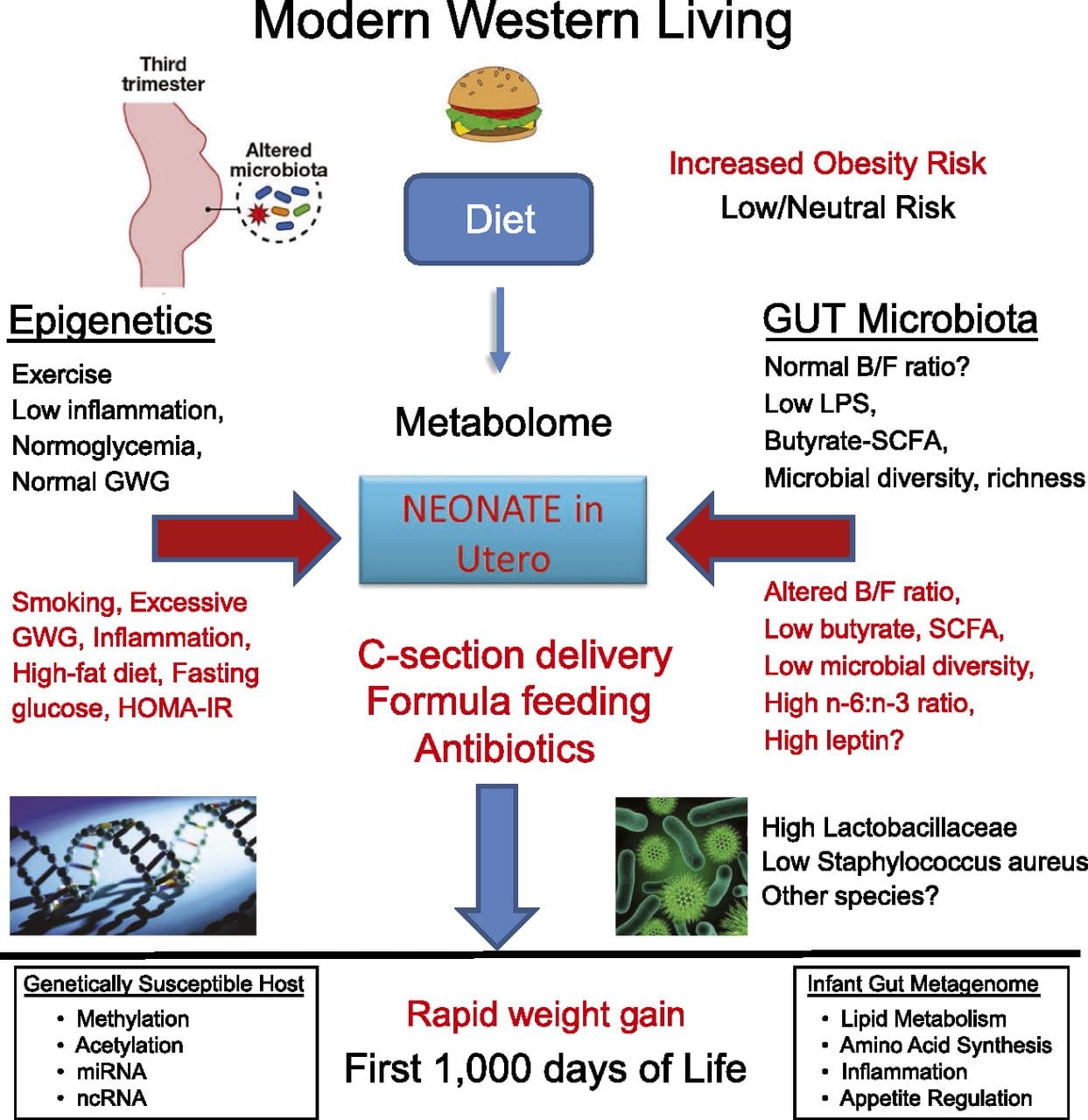 Embora muitos estudos identifiquem mudanças epigenéticas associadas à dieta em modelos animais usando regiões específicas do site candidato, foram realizadas algumas análises de todo o genoma. Um estudo recente centrou-se na determinação do impacto epigenético direto de dietas com alto teor de gordura / obesidade induzida por dieta em camundongos adultos que usam a expressão gênica do genoma e as análises de metilação do DNA [43]. Este estudo identificou as regiões diferencialmente metiladas de 232 (DMRs) em adipócitos de ratos controlados com alto teor de gordura. Importante, as regiões humanas correspondentes para os DMR murinos também foram diferencialmente metiladas no tecido adiposo de uma população de humanos obesos e magros, destacando assim a notável conservação evolutiva dessas regiões. Este resultado enfatiza a importância provável dos DMRs identificados na regulação da homeostase energética em mamíferos.
Embora muitos estudos identifiquem mudanças epigenéticas associadas à dieta em modelos animais usando regiões específicas do site candidato, foram realizadas algumas análises de todo o genoma. Um estudo recente centrou-se na determinação do impacto epigenético direto de dietas com alto teor de gordura / obesidade induzida por dieta em camundongos adultos que usam a expressão gênica do genoma e as análises de metilação do DNA [43]. Este estudo identificou as regiões diferencialmente metiladas de 232 (DMRs) em adipócitos de ratos controlados com alto teor de gordura. Importante, as regiões humanas correspondentes para os DMR murinos também foram diferencialmente metiladas no tecido adiposo de uma população de humanos obesos e magros, destacando assim a notável conservação evolutiva dessas regiões. Este resultado enfatiza a importância provável dos DMRs identificados na regulação da homeostase energética em mamíferos.
 (i) estudos de associação genética. Polimorfismos genéticos que estão associados a um risco aumentado de desenvolver doenças particulares estão, a priori, ligados aos genes causadores. A presença de metilação diferencial em tais regiões infere relevância funcional dessas mudanças epigenéticas no controle da expressão do (s) gene (s) proximal (s). Existem fortes efeitos genéticos de ação cis que sustentam grande parte da variação epigenética [7, 45] e, em estudos de base populacional, foram aplicados métodos que usam substitutos genéticos para inferir um papel causal ou mediador das diferenças de epigenoma [7, 46-48] . O uso de informação genética familiar também pode levar à identificação de regiões candidatas potencialmente causadoras que mostram metilação diferencial relacionada ao fenótipo [49].
(i) estudos de associação genética. Polimorfismos genéticos que estão associados a um risco aumentado de desenvolver doenças particulares estão, a priori, ligados aos genes causadores. A presença de metilação diferencial em tais regiões infere relevância funcional dessas mudanças epigenéticas no controle da expressão do (s) gene (s) proximal (s). Existem fortes efeitos genéticos de ação cis que sustentam grande parte da variação epigenética [7, 45] e, em estudos de base populacional, foram aplicados métodos que usam substitutos genéticos para inferir um papel causal ou mediador das diferenças de epigenoma [7, 46-48] . O uso de informação genética familiar também pode levar à identificação de regiões candidatas potencialmente causadoras que mostram metilação diferencial relacionada ao fenótipo [49].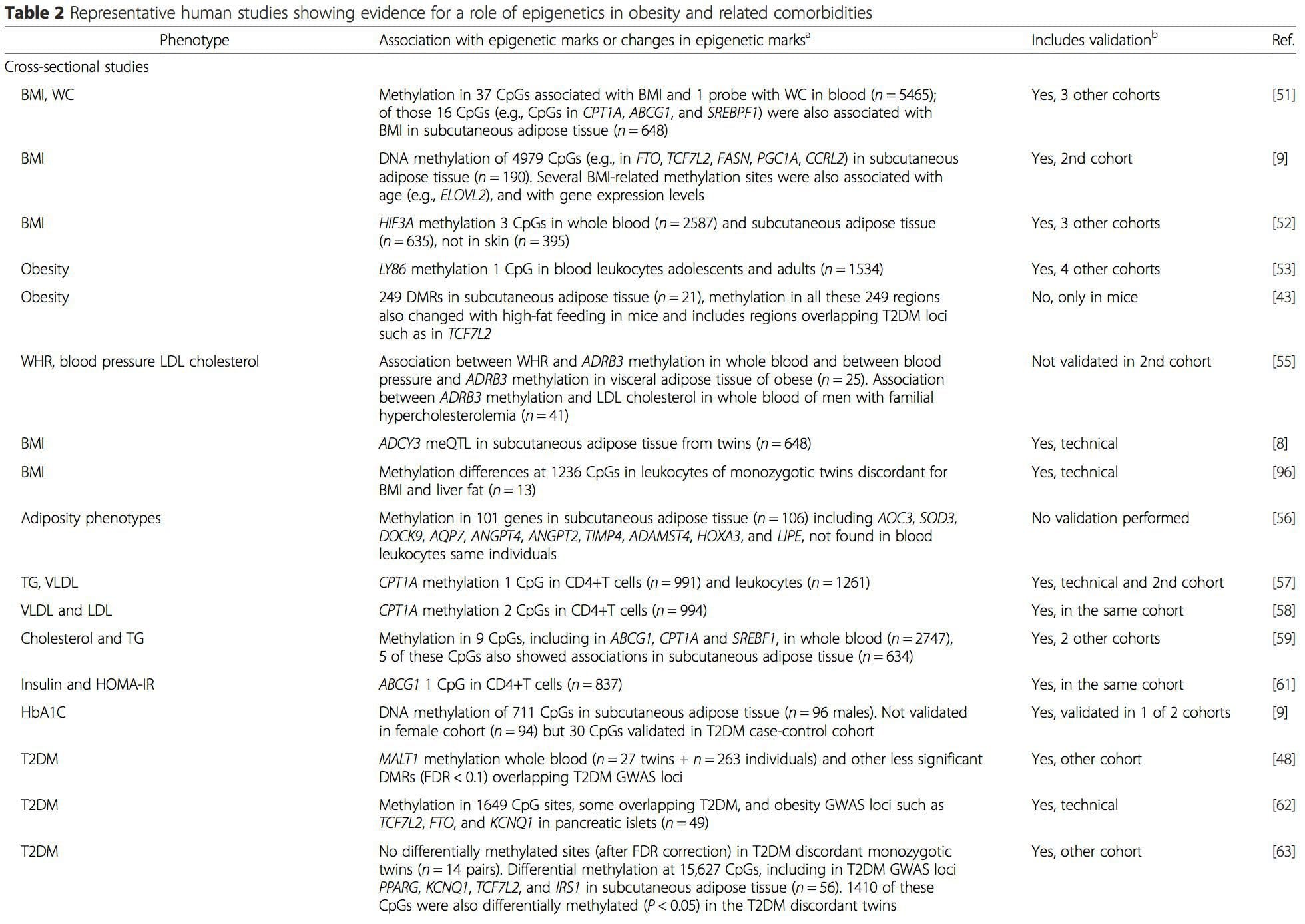
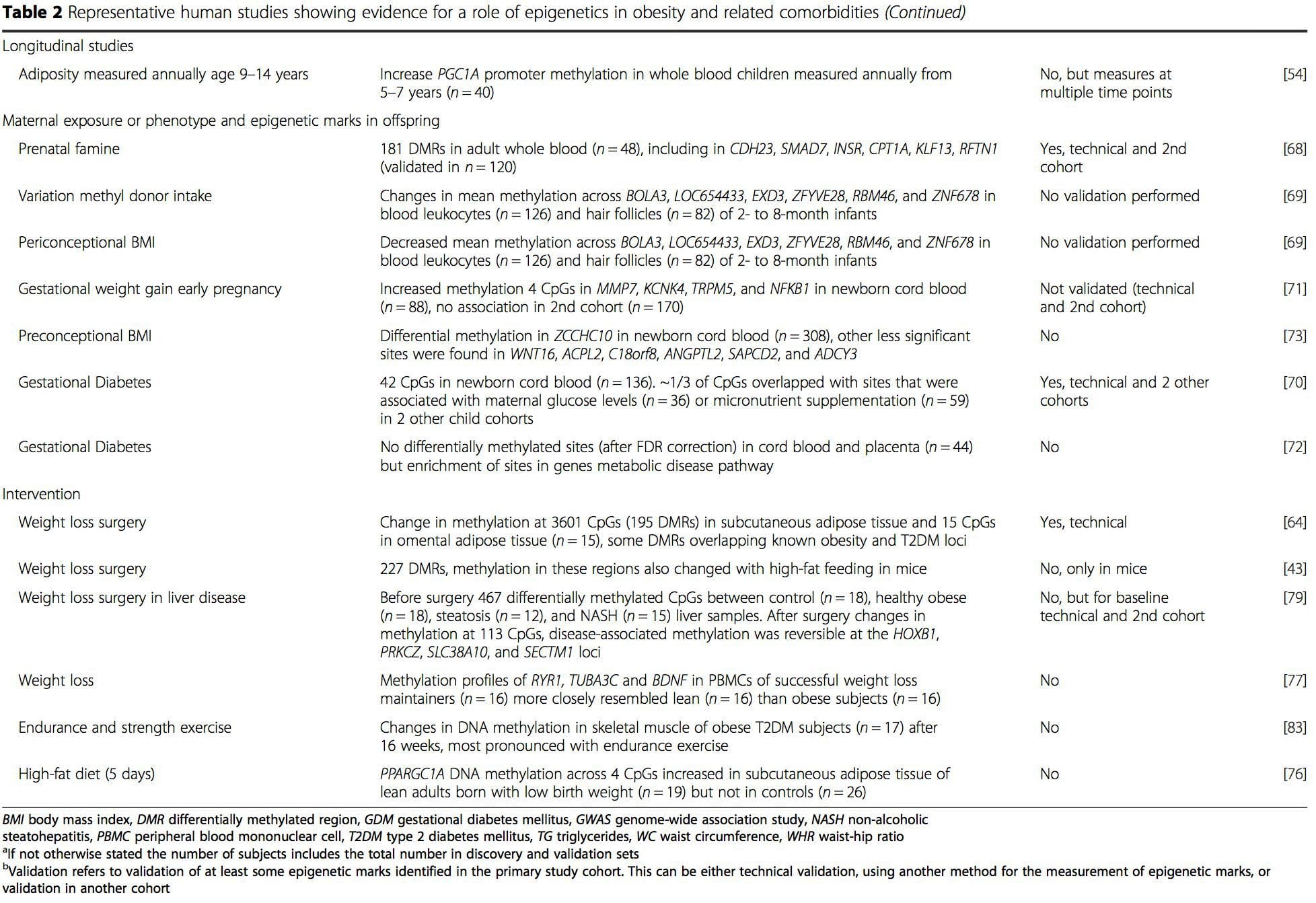 A partir destes estudos, a metilação alterada de PGC1A, HIF3A, ABCG1 e CPT1A e o RXRA [18] anteriormente descrito emergiram como biomarcadores associados ou talvez preditivos de saúde metabólica que também são candidatos plausíveis para um papel no desenvolvimento de doença metabólica .
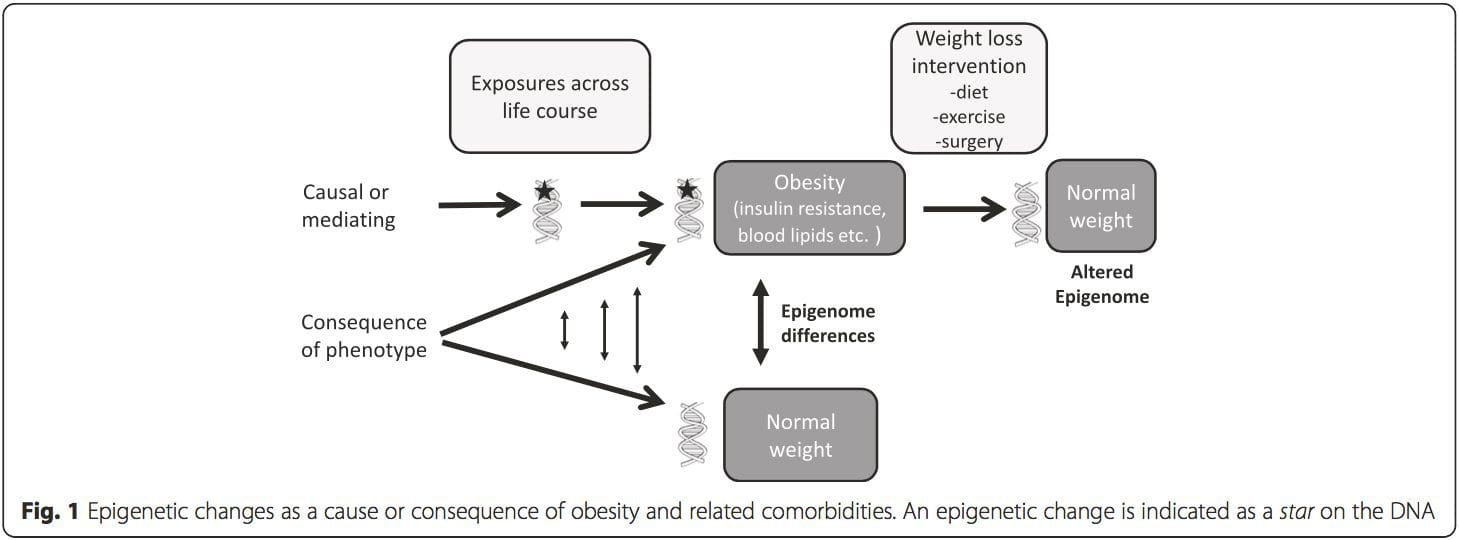
A partir destes estudos, a metilação alterada de PGC1A, HIF3A, ABCG1 e CPT1A e o RXRA [18] anteriormente descrito emergiram como biomarcadores associados ou talvez preditivos de saúde metabólica que também são candidatos plausíveis para um papel no desenvolvimento de doença metabólica . A variação epigenética é altamente influenciada pela variação genética subjacente, com o genótipo estimado para explicar ~ 20 40% da variação [6, 8]. Recentemente, vários estudos começaram a integrar dados de metiloma e genótipo para identificar loci de traços quantitativos de metilação (meQTL) associados a fenótipos de doenças. Por exemplo, no tecido adiposo, uma sobreposição de meQTL com um locus de risco genético de IMC foi identificada em um elemento potenciador a montante de ADCY3 [8]. Outros estudos também identificaram sobreposições entre os loci de risco conhecidos da obesidade e do DM2 e os DMRs associados à obesidade e ao DM2 [43, 48, 62]. A metilação de alguns desses DMRs também foi modulada por alimentação com alto teor de gordura em camundongos [43] e perda de peso em humanos [64]. Esses resultados identificam uma ligação intrigante entre variações genéticas ligadas à suscetibilidade a doenças e sua associação com regiões do genoma que sofrem modificações epigenéticas em resposta a desafios nutricionais, implicando em uma relação causal. A estreita conexão entre a variação genética e epigenética pode significar seus papéis essenciais na geração de variação individual [65, 66]. No entanto, embora essas descobertas sugiram que a metilação do DNA pode ser um mediador dos efeitos genéticos, também é importante considerar que os processos genéticos e epigenéticos podem atuar independentemente nos mesmos genes. Estudos de gêmeos [8, 63, 67] podem fornecer informações importantes e indicar que as diferenças interindividuais nos níveis de metilação do DNA surgem predominantemente de ambiente não compartilhado e influências estocásticas, minimamente de efeitos ambientais compartilhados, mas também com um impacto significativo de genética variação.
A variação epigenética é altamente influenciada pela variação genética subjacente, com o genótipo estimado para explicar ~ 20 40% da variação [6, 8]. Recentemente, vários estudos começaram a integrar dados de metiloma e genótipo para identificar loci de traços quantitativos de metilação (meQTL) associados a fenótipos de doenças. Por exemplo, no tecido adiposo, uma sobreposição de meQTL com um locus de risco genético de IMC foi identificada em um elemento potenciador a montante de ADCY3 [8]. Outros estudos também identificaram sobreposições entre os loci de risco conhecidos da obesidade e do DM2 e os DMRs associados à obesidade e ao DM2 [43, 48, 62]. A metilação de alguns desses DMRs também foi modulada por alimentação com alto teor de gordura em camundongos [43] e perda de peso em humanos [64]. Esses resultados identificam uma ligação intrigante entre variações genéticas ligadas à suscetibilidade a doenças e sua associação com regiões do genoma que sofrem modificações epigenéticas em resposta a desafios nutricionais, implicando em uma relação causal. A estreita conexão entre a variação genética e epigenética pode significar seus papéis essenciais na geração de variação individual [65, 66]. No entanto, embora essas descobertas sugiram que a metilação do DNA pode ser um mediador dos efeitos genéticos, também é importante considerar que os processos genéticos e epigenéticos podem atuar independentemente nos mesmos genes. Estudos de gêmeos [8, 63, 67] podem fornecer informações importantes e indicar que as diferenças interindividuais nos níveis de metilação do DNA surgem predominantemente de ambiente não compartilhado e influências estocásticas, minimamente de efeitos ambientais compartilhados, mas também com um impacto significativo de genética variação. Ambiente pré-natal: Dois estudos publicados recentemente fizeram uso de populações humanas que experimentaram variações naturais no suprimento de nutrientes para estudar o impacto da nutrição materna antes ou durante a gravidez na metilação do DNA na prole [68, 69]. O primeiro estudo usou uma coorte mãe-filho da Gâmbia para mostrar que tanto as variações sazonais na ingestão materna de doadores de metila durante a gravidez quanto o IMC materno pré-gravidez estavam associadas à metilação alterada nos bebês [69]. O segundo estudo utilizou descendentes adultos da coorte Dutch Hunger Winter para investigar o efeito da exposição pré-natal a um período agudo de desnutrição materna severa na metilação do DNA de genes envolvidos no crescimento e metabolismo na idade adulta [68]. Os resultados destacaram a importância do momento da exposição em seu impacto sobre o epigenoma, uma vez que efeitos epigenéticos significativos só foram identificados em indivíduos expostos à fome no início da gestação. É importante ressaltar que as mudanças epigenéticas ocorreram em conjunto com o aumento do IMC; no entanto, não foi possível estabelecer neste estudo se essas alterações ocorreram mais cedo na vida ou em decorrência do IMC mais elevado.
Ambiente pré-natal: Dois estudos publicados recentemente fizeram uso de populações humanas que experimentaram variações naturais no suprimento de nutrientes para estudar o impacto da nutrição materna antes ou durante a gravidez na metilação do DNA na prole [68, 69]. O primeiro estudo usou uma coorte mãe-filho da Gâmbia para mostrar que tanto as variações sazonais na ingestão materna de doadores de metila durante a gravidez quanto o IMC materno pré-gravidez estavam associadas à metilação alterada nos bebês [69]. O segundo estudo utilizou descendentes adultos da coorte Dutch Hunger Winter para investigar o efeito da exposição pré-natal a um período agudo de desnutrição materna severa na metilação do DNA de genes envolvidos no crescimento e metabolismo na idade adulta [68]. Os resultados destacaram a importância do momento da exposição em seu impacto sobre o epigenoma, uma vez que efeitos epigenéticos significativos só foram identificados em indivíduos expostos à fome no início da gestação. É importante ressaltar que as mudanças epigenéticas ocorreram em conjunto com o aumento do IMC; no entanto, não foi possível estabelecer neste estudo se essas alterações ocorreram mais cedo na vida ou em decorrência do IMC mais elevado. Ambiente pós-natal: O epigenoma é estabelecido de novo durante o desenvolvimento embrionário e, portanto, o ambiente pré-natal provavelmente tem o impacto mais significativo no epigenoma. No entanto, agora está claro que mudanças ocorrem no epigenoma maturo sob a influência de uma série de condições, incluindo envelhecimento, exposição a toxinas e alterações dietéticas. Por exemplo, mudanças na metilação do DNA em vários genes no músculo esquelético e PGC1A no tecido adiposo foram demonstradas em resposta a uma dieta rica em gordura [75, 76]. As intervenções para perder massa de gordura corporal também foram associadas a mudanças na metilação do DNA. Estudos relataram que os perfis de metilação do DNA do tecido adiposo [43, 64], células mononucleares do sangue periférico [77] e tecido muscular [78] em pacientes anteriormente obesos tornam-se mais semelhantes aos perfis de indivíduos magros após a perda de peso. A cirurgia para perda de peso também reverteu parcialmente as alterações de metilação associadas à doença hepática gordurosa não alcoólica [79] e em outro estudo levou à hipometilação de vários genes candidatos à obesidade, com efeitos mais pronunciados na gordura subcutânea em comparação com a gordura omental (visceral) [64] . O acúmulo de evidências sugere que as intervenções de exercícios também podem influenciar a metilação do DNA. A maioria desses estudos foi conduzida em indivíduos magros [80-82], mas um estudo de exercício em indivíduos obesos com DM2 também demonstrou mudanças na metilação do DNA, incluindo genes envolvidos no transporte de ácido graxo e glicose [83]. Mudanças epigenéticas também ocorrem com o envelhecimento, e dados recentes sugerem um papel da obesidade em aumentá-las [9, 84, 85]. A obesidade acelerou a idade epigenética do tecido hepático, mas em contraste com os achados descritos acima, este efeito não foi reversível após a perda de peso [84].
Ambiente pós-natal: O epigenoma é estabelecido de novo durante o desenvolvimento embrionário e, portanto, o ambiente pré-natal provavelmente tem o impacto mais significativo no epigenoma. No entanto, agora está claro que mudanças ocorrem no epigenoma maturo sob a influência de uma série de condições, incluindo envelhecimento, exposição a toxinas e alterações dietéticas. Por exemplo, mudanças na metilação do DNA em vários genes no músculo esquelético e PGC1A no tecido adiposo foram demonstradas em resposta a uma dieta rica em gordura [75, 76]. As intervenções para perder massa de gordura corporal também foram associadas a mudanças na metilação do DNA. Estudos relataram que os perfis de metilação do DNA do tecido adiposo [43, 64], células mononucleares do sangue periférico [77] e tecido muscular [78] em pacientes anteriormente obesos tornam-se mais semelhantes aos perfis de indivíduos magros após a perda de peso. A cirurgia para perda de peso também reverteu parcialmente as alterações de metilação associadas à doença hepática gordurosa não alcoólica [79] e em outro estudo levou à hipometilação de vários genes candidatos à obesidade, com efeitos mais pronunciados na gordura subcutânea em comparação com a gordura omental (visceral) [64] . O acúmulo de evidências sugere que as intervenções de exercícios também podem influenciar a metilação do DNA. A maioria desses estudos foi conduzida em indivíduos magros [80-82], mas um estudo de exercício em indivíduos obesos com DM2 também demonstrou mudanças na metilação do DNA, incluindo genes envolvidos no transporte de ácido graxo e glicose [83]. Mudanças epigenéticas também ocorrem com o envelhecimento, e dados recentes sugerem um papel da obesidade em aumentá-las [9, 84, 85]. A obesidade acelerou a idade epigenética do tecido hepático, mas em contraste com os achados descritos acima, este efeito não foi reversível após a perda de peso [84].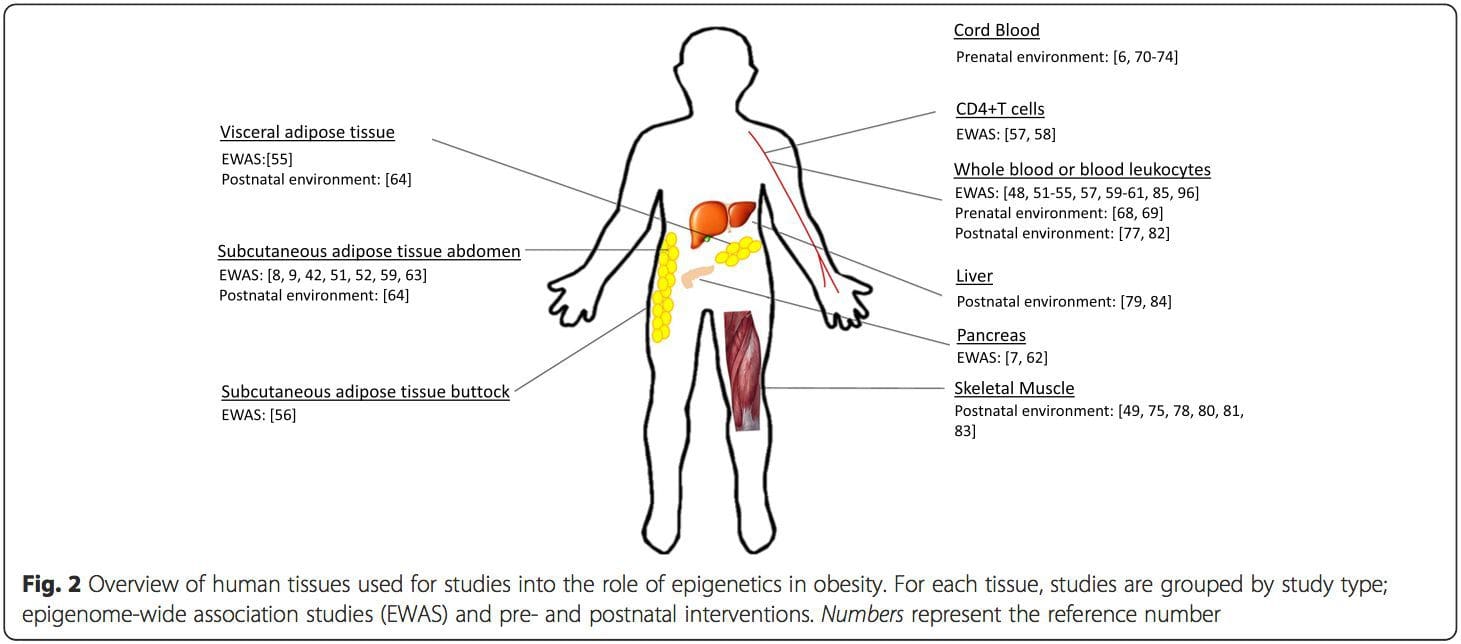 Conclusões
Conclusões



