Alessio Nencioni, Irene Caffa e Salvatore Cortellino
Resumo | A vulnerabilidade das células cancerosas à privação de nutrientes e sua dependência de metabólitos específicos são marcas emergentes do câncer. Dietas de jejum ou imitação de jejum (FMDs) levam a grandes alterações nos fatores de crescimento e nos níveis de metabólitos, gerando ambientes que podem reduzir a capacidade das células cancerígenas se adaptarem e sobreviverem, melhorando assim os efeitos das terapias contra o câncer. Além disso, o jejum ou as aftas aumentam a resistência à quimioterapia em células normais, mas não em células cancerígenas, e promovem a regeneração em tecidos normais, o que poderia ajudar a prevenir os efeitos colaterais prejudiciais e potencialmente letais dos tratamentos. Embora o jejum seja dificilmente tolerado pelos pacientes, estudos clínicos e de animais mostram que ciclos de febre aftosa de baixa caloria são viáveis e seguros em geral. Diversos ensaios clínicos que avaliaram o efeito do jejum ou das DMFs em eventos adversos emergentes do tratamento e nos resultados de eficácia estão em andamento. Nós propomos que a combinação de FA com quimioterapia, imunoterapia ou outros tratamentos representa uma estratégia potencialmente promissora para aumentar a eficácia do tratamento, prevenir a aquisição de resistência e reduzir os efeitos colaterais.
Fatores dietéticos e relacionados ao estilo de vida são os principais determinantes do risco de desenvolver câncer, com certos tipos de câncer sendo mais dependentes de hábitos alimentares do que outros1
Embora na última década tenhamos testemunhado mudanças sem precedentes e avanços notáveis no tratamento do câncer, continua a haver uma necessidade crucial de mais eficácia e, possivelmente,
O jejum força as células saudáveis a entrarem em um modo de divisão lenta e altamente protegido que as protege contra insultos tóxicos derivados de drogas anticâncer, enquanto sensibiliza diferentes tipos de células cancerígenas a essas terapêuticas11,12,17. Esta descoberta implica que uma única intervenção dietética poderia potencialmente ajudar a abordar aspectos diferentes e igualmente importantes da terapia do câncer.
Neste artigo, discutimos a lógica biológica de usar dietas de jejum ou de imitação de jejum (FMDs) para neutralizar os TEAEs, mas também para prevenir e tratar o câncer. Também ilustramos as ressalvas desta abordagem experimental 18,19 e os estudos clínicos publicados e em andamento nos quais o jejum ou as aflações por febre aftosa foram aplicadas em pacientes com câncer.
Conteúdo
Resposta de jejum sistêmica e celular
O jejum leva a mudanças na atividade de muitas vias metabólicas associadas à mudança para um modo capaz de gerar energia e metabolitos usando fontes de carbono liberadas principalmente do tecido adiposo e em parte do músculo. As mudanças nos níveis de hormônios e metabólitos circulantes traduzem-se em uma redução na divisão celular e atividade metabólica de células normais e, finalmente, protegê-los de insultos quimioterápicos11,12. As células cancerígenas, ao desobedecer as ordens anti-crescimento ditadas por estas condições de fome, podem ter a resposta oposta das células normais e, portanto, tornam-se sensibilizadas para a quimioterapia e outras terapias contra o câncer.
Resposta sistêmica ao jejum
A resposta ao jejum é orquestrada em parte pelos níveis circulantes de glicose, insulina, glucagon, hormônio de crescimento (GH), IGF1, glicocorticóides.
O glucagon e os baixos níveis de insulina também estimulam a decomposição dos triglicerídeos (que são principalmente armazenados no tecido adiposo) em glicerol e ácidos graxos livres. Durante o jejum, a maioria dos tecidos utiliza ácidos graxos para energia, enquanto o cérebro depende da glicose e dos corpos cetônicos produzidos pelos hepatócitos (os corpos cetônicos podem ser produzidos a partir da acetil-CoA gerada a partir da? -Oxidação do ácido graxo ou dos aminoácidos cetogênicos). Na fase cetogênica do jejum, os corpos cetônicos atingem concentrações na faixa milimolar, tipicamente começando após 2 3 dias do início do jejum. Junto com o glicerol e os aminoácidos derivados da gordura, os corpos cetônicos alimentam a gliconeogênese, que mantém os níveis de glicose em uma concentração de aproximadamente 4 mM (70 mg por dl), que é utilizada principalmente pelo cérebro.
Os glicocorticóides e a adrenalina também contribuem para direcionar as adaptações metabólicas
Finalmente, o jejum diminui os níveis de leptina circulante, um hormônio predominantemente formado por adipócitos que inibe a fome, enquanto aumenta os níveis de adiponectina, o que aumenta a degradação de ácidos graxos 23,24. Assim, em conclusão, as características da resposta sistêmica dos mamíferos ao jejum são baixos níveis de glicose e insulina, altos níveis de glucagon e corpos cetônicos, baixos níveis de IGF1 e leptina e altos níveis de adiponectina.
Resposta Celular ao Jejum
A resposta de células saudáveis ao jejum é conservada evolutivamente e confere proteção celular, e pelo menos em organismos modelo, tem demonstrado aumentar a expectativa de vida e saúde12,22,25 31. O IGF1
O jejum e a restrição de glicose resultante inibem a atividade da PKA, aumentam a atividade da AMPK e ativam o EGR1 e, assim, alcançam efeitos protetores das células, incluindo aqueles no miocárdio22,25,26. Por último, o jejum e os FMDs (ver abaixo sua composição) também têm a capacidade de promover efeitos regenerativos (Quadro 1) por mecanismos moleculares, alguns dos quais têm sido implicados no câncer, como autofagia aumentada ou indução da atividade da sirtuína22,37-49 .

Abordagens dietéticas em câncer de febre aftosa
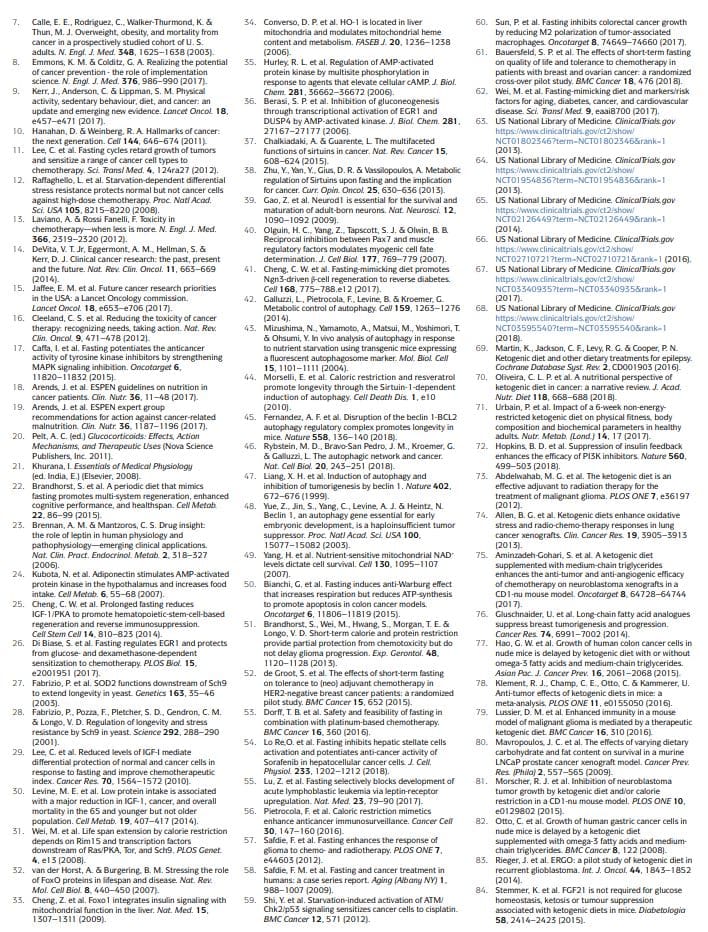
As abordagens dietéticas baseadas em jejum que foram investigadas mais extensivamente em oncologia, tanto pré-clínica quanto clinicamente, incluem jejum de água (abstinência de todos os alimentos e bebidas, exceto água) e FMDs11,12,17,25,26,50 60 (Tabela 1). Dados clínicos preliminares indicam que um jejum de pelo menos 48 horas pode ser necessário para alcançar efeitos clinicamente significativos em oncologia, como prevenir danos ao DNA induzidos por quimioterapia em tecidos saudáveis e ajudar a manter
No entanto, a maioria dos pacientes se recusa ou tem dificuldade em completar o jejum com água, e os riscos potenciais da deficiência calórica e de micronutrientes associados a isso são difíceis de justificar. Os FMDs são regimes dietéticos medicamente concebidos com muito baixo teor de calorias (ou seja, normalmente entre 300 e 1,100kcal por dia), açúcares e proteínas que recriam muitos dos efeitos do jejum apenas com água, mas com melhor adesão do paciente e risco nutricional reduzido22,61,62, 3 Durante uma febre aftosa, os pacientes geralmente recebem quantidades irrestritas de água, pequenas porções padronizadas de caldos de vegetais, sopas, sucos, barras de nozes e chás de ervas, bem como suplementos de micronutrientes. Em um estudo clínico de 5 ciclos mensais de uma febre aftosa de 1 dias em indivíduos geralmente saudáveis, a dieta foi bem tolerada e reduziu o tronco e a gordura corporal total, a pressão arterial e os níveis de IGF62. Em ensaios clínicos oncológicos anteriores e em andamento, jejum ou FMDs têm sido administrados a cada 3 4 semanas, por exemplo, em combinação com regimes de quimioterapia, e sua duração variou entre 1 e 5 dias52,53,58,61,63 68 . É importante ressaltar que nenhum evento adverso sério (nível G3 ou acima, de acordo com os Critérios de Terminologia Comum para Eventos Adversos) foi relatado nestes estudos52,53,58,61.
Dietas cetogênicas
As dietas cetogênicas (KDs) são regimes alimentares com teor calórico normal, alto teor de gordura e baixo teor de carboidratos69,70. Em um KD clássico, a proporção entre o peso da gordura e o peso combinado de carboidratos e proteínas é de 4: 1. Digno de nota, os FMDs também são cetogênicos porque têm alto teor de gordura e têm a capacidade de induzir elevações substanciais (~ 0.5 mmol por litro) nos níveis de corpos cetônicos circulantes. Em humanos, um KD também pode reduzir os níveis de IGF1 e insulina (em mais de 20% dos valores basais), embora esses efeitos sejam afetados pelos níveis e tipos de carboidratos e proteínas na dieta71. Os KDs podem reduzir os níveis de glicose no sangue, mas normalmente permanecem dentro da faixa normal (ou seja,> 4.4 mmol por litro) 71.
Notavelmente, os KDs podem ser eficazes para prevenir o aumento da glicose e da insulina que ocorre tipicamente em resposta aos inibidores de PI3K, que foi proposto para limitar sua eficácia72. Tradicionalmente, as DKs têm sido utilizadas no tratamento da epilepsia refratária, principalmente em crianças69. Em modelos de camundongos, os KDs induzem efeitos anticâncer, particularmente no glioblastoma70,72 86. Estudos clínicos indicam que KDs provavelmente não têm atividade terapêutica substancial quando usados como agentes únicos em pacientes com câncer e sugerem que os benefícios potenciais dessas dietas devem ser buscados em combinação com outras abordagens, como quimioterapia, radioterapia, tratamentos antiangiogênicos, inibidores de PI3K
Foi relatado que os KDs têm efeitos neuroprotetores nos nervos periféricos e no hipocampo87,88. No entanto, ainda não foi estabelecido se os KDs também têm efeitos prorregenerativos semelhantes ao jejum ou FMDs (Quadro 1) e se os KDs também podem ser usados para proteger mamíferos vivos da toxicidade da quimioterapia. Notavelmente, os efeitos regenerativos do jejum ou FMDs parecem ser maximizados pela mudança do modo de resposta à fome, que envolve a quebra de componentes celulares e a morte de muitas células, e o período de realimentação, no qual as células e tecidos sofrem reconstrução22. Como os KDs não forçam a entrada em um modo de inanição, não promovem uma grande degradação dos componentes e tecidos intracelulares e não incluem um período de realimentação, é improvável que causem o tipo de regeneração coordenada observada durante a realimentação da febre aftosa.
Restrição de calorias
Embora a restrição calórica (RC) crônica e as dietas deficientes em aminoácidos específicos sejam muito diferentes do jejum periódico, elas compartilham com o jejum e a febre aftosa uma restrição mais ou menos seletiva de nutrientes e têm efeitos anticâncer81,89 112. A RC tipicamente envolve uma redução crônica de 20 a 30% na ingestão de energia a partir da ingestão de calorias padrão que permitiria a um indivíduo manter um peso normal113,114. É muito eficaz na redução dos fatores de risco cardiovascular e incidência de câncer em organismos modelo, incluindo primatas108,109,114.
No entanto, a RC pode causar efeitos colaterais, como alterações na aparência física, aumento da sensibilidade ao frio, redução da força, irregularidades menstruais, infertilidade, perda da libido, osteoporose, cicatrização mais lenta de feridas, obsessão por comida, irritabilidade e depressão. Em pacientes com câncer, existem preocupações substanciais de que pode exacerbar a desnutrição e inevitavelmente causar perda excessiva de massa corporal magra18,113 116. A RC reduz os níveis de glicose no sangue em jejum, embora permaneçam dentro da faixa normal114. Em humanos, a RC crônica não afeta os níveis de IGF1, a menos que uma restrição moderada de proteínas também seja implementada117.
Estudos mostram que, ao reduzir a sinalização mTORC1 em células de Paneth, CR aumenta sua função de células-tronco e também protege as células-tronco intestinais de danos no DNA, mas não se sabe se os efeitos pró-regenerativos em outros órgãos também são provocados pela RC. Assim, os dados disponíveis sugerem que o jejum e as FMDs criam um perfil metabólico, regenerativo e protetor que é distinto e provavelmente mais potente que aquele provocado por um KD ou CR.
Jejum e FMDs na terapia: efeitos sobre os níveis de hormônios e metabólitos
Muitas das alterações nos níveis de hormônios e metabólitos circulantes que são tipicamente observados em resposta ao jejum têm a capacidade de exercer efeitos antitumorais (isto é, níveis reduzidos de glicose, IGF1, insulina e leptina e níveis aumentados de adiponectina) 23,120,121 e / ou para proteger os tecidos saudáveis dos efeitos colaterais (isto é, níveis reduzidos de IGF1 e glicose). Como os corpos cetônicos podem inibir as histonas desacetilases (HDACs), o aumento dos corpos cetônicos induzido pelo jejum pode ajudar a retardar o crescimento do tumor e promover a diferenciação através de mecanismos epigenéticos122.
No entanto, foi demonstrado que o acetoacetato de corpos cetônicos acelera, em vez de reduzir, o crescimento de certos tumores, como melanomas com BRAF123 mutado. As mudanças para as quais há evidências mais fortes de um papel nos efeitos benéficos do jejum e da febre aftosa contra o câncer são as reduções nos níveis de IGF1 e glicose. No nível molecular, o jejum ou FMD reduz as cascatas de sinalização intracelular, incluindo a sinalização de IGF1R AKT mTOR S6K e cAMP PKA, aumenta a autofagia, ajuda as células normais a resistir ao estresse e promove a imunidade anticâncer25,29,56,124
Resistência Diferencial ao Estresse: Aumentando a Tolerabilidade à Quimioterapia
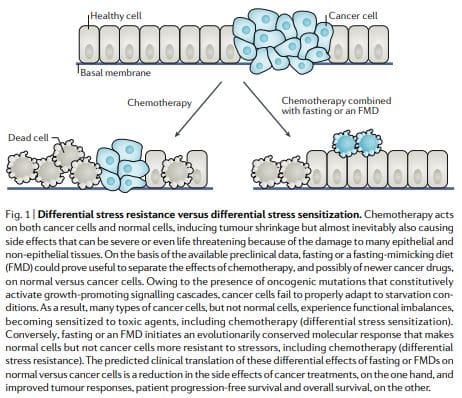
Alguns ortólogos de oncogene de levedura, como Ras e Sch9 (ortólogo funcional de mamíferos S6K), são capazes de diminuir a resistência ao estresse em organismos modelo27,28. Além disso, mutações que ativam IGF1R, RAS, PI3KCA ou AKT, ou que inativam PTEN, estão presentes na maioria dos cânceres humanos10. Juntos, isso levou à hipótese de que a inanição causaria efeitos opostos no câncer versus células normais em termos de sua capacidade de resistir a estressores celulares, incluindo quimioterápicos. Em outras palavras, a fome pode levar a
De acordo com a hipótese DSR, as células normais respondem à inanição pela regulação negativa da proliferação associada e da biogênese do ribossomo e / ou genes de montagem, o que força as células a entrarem em um modo de auto-manutenção e as protege dos danos causados pela quimioterapia, radioterapia e outros agentes tóxicos. Por outro lado, nas células cancerosas, esse modo de auto-manutenção é evitado por meio de alterações oncogênicas, que causam a inibição constitutiva das vias de resposta ao estresse12 (Fig. 1). Consistente com o modelo DSR, inanição a curto prazo ou a exclusão do proto-oncogene
Obtiveram-se resultados semelhantes em culas de mamero: exposio a culas glia de ratinho primias protegidas com meio de baixa glucose contra toxicidade de perido de hidrogio ou ciclofosfamida (um quimioteraptico prooxidante) mas n protegeram linhas celulares de glioma de murganho e neuroblastoma de ratinho, rato e humano. Consistente com estas observações,
Estudos subsequentes descobriram que a sinalização reduzida de IGF1 em resposta ao jejum protege a glia primária e os neurônios, mas não as células de glioma e neuroblastoma, da ciclofosfamida e de compostos pró-oxidativos e protege os fibroblastos embrionários de camundongo da doxorrubicina29. Camundongos com deficiência de IGF1 hepático (LID), animais transgênicos com uma deleção do gene Igf1 do fígado condicional que exibem uma redução de 70-80% nos níveis circulantes de IGF1 (níveis semelhantes aos alcançados por um jejum de 72 horas em camundongos) 29,125, foram protegidos contra três em cada quatro drogas quimioterápicas testadas, incluindo a doxorrubicina.
Estudos histológicos mostraram sinais de miopatia cardíaca induzida por doxorrubicina apenas em camundongos de controle tratados com doxorrubicina, mas não em camundongos LID. Em experimentos com animais portadores de melanoma tratados com doxorrubicina, nenhuma diferença em termos de progressão da doença entre os camundongos controle e LID foi observada, indicando que as células cancerosas não foram protegidas da quimioterapia por níveis reduzidos de IGF1. Ainda, novamente, camundongos LID portadores de tumor exibiram uma vantagem de sobrevivência notável em comparação com os animais de controle, devido à sua capacidade de resistir à toxicidade da doxorrubicina29. Assim, em geral, esses resultados confirmaram que a regulação negativa de IGF1 é um mecanismo-chave pelo qual o jejum aumenta a tolerabilidade da quimioterapia.
Tanto a dexametasona como os inibidores da mTOR são amplamente utilizados no tratamento do câncer, seja devido à sua eficácia como anti-eméticos e
Estas intervenções reduzem a atividade de PKA enquanto aumentam a atividade de AMPK e, assim, ativam EGR1, indicando que a sinalização de cAMP PKA medeia o DSR induzido por jejum via EGR1 (ref. 26). O EGR1 também promove a expressão de peptídeos cardioprotetores, como o peptídeo natriurético atrial (ANP) e o peptídeo natriurético tipo B (BNP) no tecido cardíaco, que contribui para a resistência à doxorrubicina. Além disso, o jejum e / ou febre aftosa pode proteger camundongos da cardiomiopatia induzida por doxorrubicina, aumentando a autofagia, o que pode promover a saúde celular, reduzindo a produção de espécies reativas de oxigênio (ROS) por meio da eliminação de mitocôndrias disfuncionais e pela remoção de agregados tóxicos.
Além de reduzir a toxicidade celular induzida pela quimioterapia e aumentar a sobrevida de camundongos tratados com quimioterapia, os ciclos de jejum induzem a regeneração da medula óssea e previnem a imunossupressão causada pela ciclofosfamida de forma relacionada à PKA e IGF1. Assim, resultados pré-clínicos convincentes indicam o potencial do jejum e FMDs para aumentar a tolerabilidade da quimioterapia e evitar efeitos colaterais importantes. Como os dados clínicos iniciais dão mais suporte a esse potencial, esses estudos pré-clínicos constroem uma base lógica forte para avaliar a febre aftosa em ensaios clínicos randomizados com TEAEs como desfecho primário.
Sensibilização Diferencial por Estresse: Aumentando a Morte de Células Câncer
Se usado sozinho, a maioria das intervenções dietéticas, incluindo o jejum e a febre aftosa, têm efeitos limitados contra a progressão do câncer. De acordo com a hipótese do diferencial de sensibilização ao estresse (DSS), a combinação de jejum ou febre aftosa com um segundo tratamento é muito mais promissora com o 11,12. Esta hipótese prevê que, enquanto as células cancerígenas são capazes de se adaptar às concentrações limitadas de oxigênio e nutrientes, muitos tipos de células cancerígenas não são capazes de realizar mudanças que permitam a sobrevivência no ambiente deficiente em nutrientes e tóxicos gerados pela combinação de quimioterapia e jejum. , por exemplo. Primeiros experimentos em câncer de mama, melanoma
Consideramos uma resposta inadequada das células cancerígenas às condições alteradas, incluindo a redução do IGF1 e os níveis de glicose causados pelo jejum ou pelas FAs como um mecanismo chave subjacente à doença.

Ao reduzir a disponibilidade de glicose e aumentar a? -Oxidação de ácidos graxos, o jejum ou FMDs também podem promover uma mudança da glicólise aeróbica (efeito Warburg) para a fosforilação oxidativa mitocondrial em células cancerosas, que é necessária para sustentar o crescimento das células cancerosas no ambiente mais pobre em nutrientes50 (Figura 2). Essa mudança leva ao aumento da produção de ROS11 como resultado do aumento da atividade respiratória mitocondrial e também pode envolver uma redução no potencial redox celular devido à diminuição da síntese de glutationa a partir da glicólise e da via da pentose fosfato50. O efeito combinado do aumento de ROS e redução da proteção antioxidante aumenta o estresse oxidativo nas células cancerosas e amplifica a atividade dos quimioterápicos. Notavelmente, porque uma alta atividade glicolítica demonstrada pela alta produção de lactato é preditiva de agressividade e propensão metastática em vários tipos de câncer129, os efeitos anti-Warburg do jejum ou febre aftosa têm o potencial de ser particularmente eficazes contra cânceres agressivos e metastáticos.
Além de uma mudança no metabolismo, o jejum ou a febre aftosa provocam outras alterações que podem promover o DSS nas células cancerosas pancreáticas. O jejum aumenta os níveis de expressão de
Finalmente, o jejum pode regular positivamente o receptor de leptina e seu downstream
Notavelmente, é provável que muitos tipos de células cancerosas, incluindo AML29, podem adquirir resistência contornando as alterações metabólicas impostas pelo jejum ou FMDs, uma possibilidade que é ainda aumentada pela heterogeneidade metabólica que caracteriza muitos cânceres129. Assim, um dos principais objetivos para o futuro próximo será identificar os tipos de câncer mais suscetíveis a esses regimes alimentares por meio de biomarcadores. Por outro lado, quando combinados com terapias padrão, o jejum ou FMDs raramente resultam na aquisição de resistência em modelos de camundongos com câncer, e a resistência ao jejum combinada com quimioterapia também é incomum em estudos in vitro, destacando a importância de identificar terapias que, quando combinados com FMDs, resultam em efeitos tóxicos potentes contra células cancerosas com toxicidade mínima para células e tecidos normais11,17,50,55 57,59,124.
Melhoria da imunidade antitumoral por jejum ou febre aftosa
Dados recentes sugerem que o jejum ou a febre aftosa por si mesmos, e em maior extensão quando combinados com a quimioterapia, desencadeiam a expansão de progenitores linfóides e promovem
Dietas anticâncer em modelos de ratos
No geral, os resultados de estudos pré-clínicos de jejum ou FMDs em modelos de câncer animal, incluindo modelos para câncer metastático (Tabela 2), mostram que o jejum periódico ou FMDs alcançam efeitos anticâncer pleiotrópicos e potencializam a atividade de quimioterápicos e TKIs enquanto exercem efeitos protetores e regenerativos em múltiplos órgãos22,25. Alcançar os mesmos efeitos sem jejum e / ou febre aftosa exigiria primeiro a identificação e depois o uso de vários medicamentos eficazes, caros e freqüentemente tóxicos e provavelmente não teria a vantagem de induzir a proteção de células saudáveis. É digno de nota que em pelo menos dois estudos o jejum combinado com a quimioterapia provou ser a única intervenção capaz de alcançar regressões tumorais completas ou sobrevida em longo prazo em uma fração consistente dos animais tratados11,59
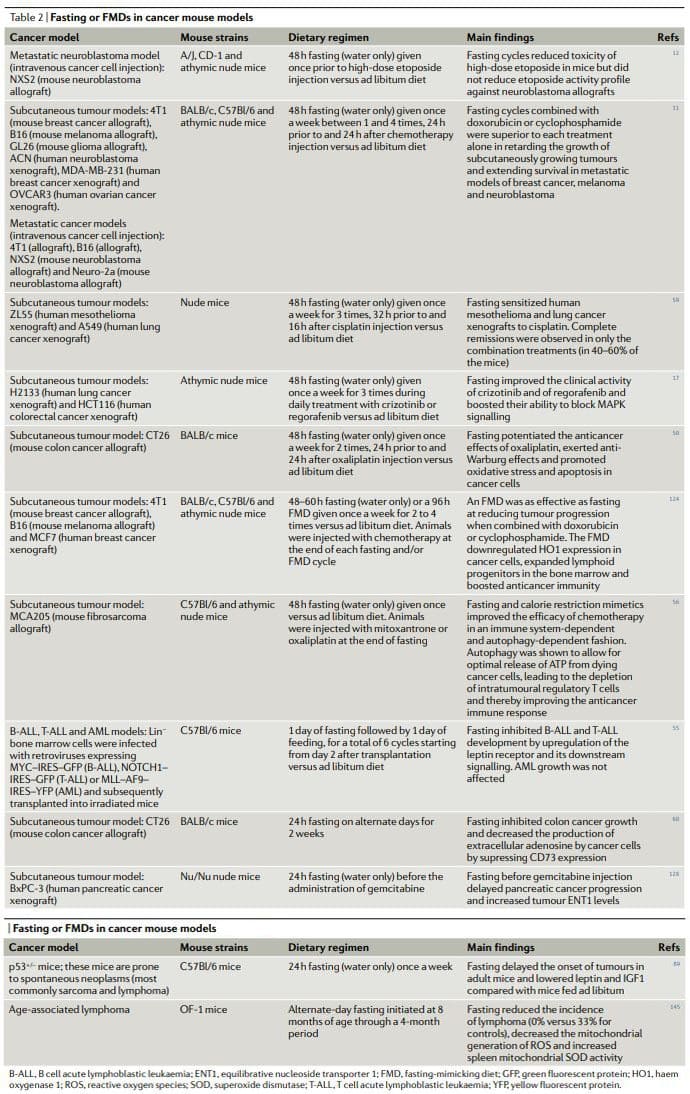
KDs crônicos também mostram
CR reduziu a tumorigênese em modelos de câncer de camundongo genético, modelos de camundongo com tumorigênese espontânea e modelos de camundongo com câncer induzido por carcinogênio, bem como em macacos91,92,97,98,101,102,104 106,108,109,136 138. Em contraste, um estudo descobriu que a RC desde a meia-idade realmente aumenta a incidência de neoplasias de células plasmáticas em camundongos C57Bl / 6. No entanto, no mesmo estudo, CR também estendeu a expectativa de vida máxima em aproximadamente 139%, e o aumento observado na incidência de câncer foi atribuído ao aumento da longevidade de camundongos submetidos a CR, a idade em que
Importante, CR melhorou a atividade do tratamento antineoplásico em vários modelos de câncer, incluindo a atividade de um anticorpo antiIGF1R (ganitumab) contra câncer de próstata141, ciclofosfamida contra células de neuroblastoma135 e inibição de autofagia em xenoenxertos de HRAS-G12Vtransformou células epiteliais renais de camundongos imortais de recém-nascidos100. No entanto, a RC ou a DK em combinação com terapias antineoplásicas parecem ser menos eficazes que o jejum. Um estudo em ratinhos descobriu que, em contraste com o jejum isolado, o RC isolado não foi capaz de reduzir o crescimento de GL26 de glutões subcutâneos em crescimento e que, novamente, em contraste com o jejum a curto prazo, o CR não aumentou a actividade da cisplatina contra o cancro subcutâneo da mama 4T1. tumours51. No mesmo estudo, o jejum também se mostrou substancialmente mais eficaz que o CR e um KD no aumento da tolerabilidade do doxorrubicina 51. Embora o jejum ou uma febre aftosa, o CR e um KD provavelmente atuem e modulem a sobreposição
A fase de realimentação poderia então
Jejum e febre aftosa na prevenção do câncer
Estudos epidemiológicos e estudos em animais, incluindo macacos 108,109,144, e humanos dão suporte à noção de que a CR crônica e o jejum periódico e / ou uma febre aftosa podem ter efeitos preventivos do câncer em humanos. No entanto, o CR dificilmente pode ser implementado na população em geral devido a questões de conformidade e possíveis efeitos colaterais do 115. Assim, enquanto as recomendações baseadas em evidências de alimentos para preferir (ou evitar), bem como recomendações de estilo de vida para reduzir o risco de câncer estão se estabelecendo, o objetivo agora é identificar e, possivelmente, padronizar regimes alimentares periódicos bem tolerados com baixa ou nenhuma efeitos colaterais e avaliar sua eficácia preventiva do câncer em estudos clínicos.
Como discutido anteriormente, os ciclos de febre aftosa causam downregulation de IGF1 e glicose e suprarregulação de IGFBP1 e corpos cetônicos, que são mudanças similares àquelas causadas pelo próprio jejum e são biomarcadores da resposta em jejum 22. Quando os ratinhos C57Bl / 6 (que se desenvolvem
Um estudo anterior de jejum em dias alternados, que foi realizado em ratos de meia-idade por um total de meses 4, também descobriu que o jejum reduziu a incidência de linfoma, levando-o de 33% para camundongos controle a 0% animais) 145, embora por causa da curta duração do estudo, não se sabe se este regime de jejum impediu ou simplesmente retardou a
Portanto, os resultados promissores dos estudos pré-clínicos combinados com os dados clínicos sobre o efeito de uma febre aftosa em fatores de risco para
Aplicabilidade Clínica em Oncologia
Quatro estudos de viabilidade de jejum e febre aftosa em pacientes submetidos a quimioterapia foram publicados a partir de hoje 52,53,58,61. Em uma série de casos de 10 pacientes diagnosticados com vários tipos de câncer, incluindo câncer de mama, próstata, ovário, útero, pulmão e esôfago, que jejuaram voluntariamente por até 140 horas antes e / ou até 56 horas após a quimioterapia, nenhum dos principais efeitos colaterais jejuando-se além da fome e tontura foram relatados 58. Aqueles pacientes (seis) que foram submetidos a quimioterapia com e sem jejum relataram uma redução significativa na fadiga, fraqueza e eventos adversos gastrointestinais durante o jejum. Além disso, naqueles pacientes nos quais a progressão do câncer poderia ser avaliada, o jejum não preveniu reduções induzidas pela quimioterapia no volume do tumor ou nos marcadores tumorais. Em outro estudo, mulheres 13 com câncer de mama HER2 (também conhecido como ERBB2), estágio II / III recebendo quimioterapia adjuvante, adriamicina e ciclofosfamida (TAC) foram randomizadas para 24 horas antes e após o início da quimioterapia ou para nutrição de acordo com as diretrizes padrão52.
O jejum de curto prazo foi bem tolerado e reduziu a queda na contagem média de eritrócitos e trombócitos 7 dias após a quimioterapia. Curiosamente, neste estudo, os níveis de? -H2AX (um marcador de dano ao DNA) aumentaram 30 minutos após a quimioterapia em leucócitos de pacientes sem jejum, mas não em pacientes que jejuaram. Em um aumento da dose de jejum em pacientes submetidos à quimioterapia à base de platina, 20 pacientes (que foram tratados principalmente para câncer urotelial, ovariano ou de mama) foram randomizados para jejuar por 24, 48 ou 72 horas (dividido em 48 horas antes da quimioterapia e 24 horas após a quimioterapia ) 53. Os critérios de viabilidade (definidos como três ou mais de seis indivíduos em cada coorte consumindo? 200kcal por dia durante o período de jejum sem excesso de toxicidade) foram atendidos. Toxicidade relacionada ao jejum
Muito recentemente, um ensaio clínico randomizado cruzado foi conduzido avaliando os efeitos de uma febre aftosa na qualidade de vida e os efeitos colaterais da quimioterapia em um total de pacientes 34 com câncer de mama ou de ovário 61. A febre aftosa consistia em
Desafios na clínica
O estudo do jejum periódico ou das FA em oncologia não é desprovido de preocupações, particularmente em relação à possibilidade de que este tipo de regime alimentar possa precipitar desnutrição, sarcopenia,
Conclusões
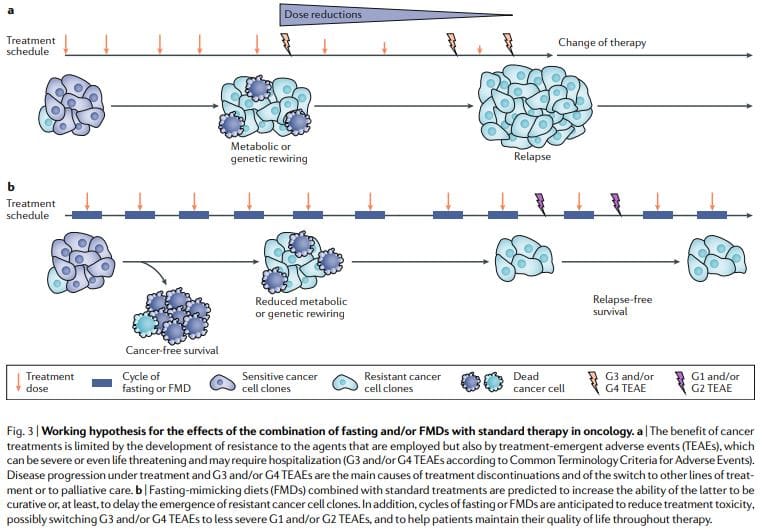
O jejum periódico ou FMDs mostram consistentemente poderosos efeitos anticâncer em modelos de câncer de camundongo, incluindo a capacidade de potencializar a quimiorradioterapia e TKIs e de desencadear a imunidade anticâncer. Os ciclos de febre aftosa são mais viáveis do que os regimes dietéticos crônicos porque permitem que os pacientes consumam alimentos regularmente durante a febre aftosa, mantêm uma dieta normal entre os ciclos e não resultam em perda severa de peso e possivelmente em efeitos prejudiciais aos sistemas imunológico e endócrino. Notavelmente, como terapias autônomas, ciclos periódicos de jejum ou FMD provavelmente mostrariam eficácia limitada contra tumores estabelecidos. Na verdade, em camundongos, o jejum ou a febre aftosa afetam a progressão de vários tipos de câncer de forma semelhante à quimioterapia, mas, isoladamente, raramente correspondem ao efeito obtido em combinação com medicamentos contra o câncer que podem resultar em sobrevida livre de câncer11,59. Assim, propomos que é a combinação de ciclos periódicos de FMD com tratamentos padrão que detém o maior potencial para promover a sobrevida livre de câncer em pacientes, como sugerido pelos modelos de camundongos11,59 (Fig. 3).
Essa combinação pode ser particularmente potente por várias razões: primeiro, drogas contra o câncer e outras terapias podem ser eficazes, mas uma parcela dos pacientes não responde porque as células cancerígenas adotam estratégias metabólicas alternativas que levam à sobrevivência. Esses modos metabólicos alternativos são muito mais difíceis de suportar em condições de jejum ou febre aftosa, devido às deficiências ou mudanças na glicose, certos aminoácidos, hormônios e fatores de crescimento, bem como em outras vias desconhecidas que levam à morte celular. Em segundo lugar, o jejum ou as FMDs podem prevenir ou reduzir a aquisição de resistência. Terceiro, o jejum ou a febre aftosa protegem as células e órgãos normais dos efeitos colaterais causados por uma ampla variedade de drogas contra o câncer. Com base em evidências pré-clínicas e clínicas de viabilidade, segurança e eficácia (na redução de IGF1, gordura visceral
Além disso, é essencial a aplicação de FMDs com uma compreensão dos mecanismos de ação, uma vez que sua potência
Estudos clínicos em andamento de FMDs em pacientes com câncer63,65 68 fornecerão respostas mais sólidas sobre se a prescrição periódica de FMDs em combinação com agentes anticâncer convencionais ajuda a melhorar a tolerabilidade e a atividade destes últimos. É importante considerar que os FMDs não serão eficazes na redução dos efeitos colaterais dos tratamentos de câncer em todos os pacientes e nem trabalharão para melhorar a eficácia de todas as terapias, mas eles têm grande potencial para fazê-lo, pelo menos por uma parte e possivelmente para a maior parte dos pacientes e medicamentos. Pacientes frágeis ou desnutridos ou pacientes em risco de desnutrição não devem ser incluídos em estudos clínicos de jejum ou DMF, e o estado nutricional do paciente e anorexia devem ser monitorados cuidadosamente durante os estudos clínicos.
Referências:
Escopo de prática profissional *
As informações aqui contidas em "Jejum e Câncer: Mecanismos Moleculares e Aplicação Clínica" não se destina a substituir um relacionamento individual com um profissional de saúde qualificado ou médico licenciado e não é um conselho médico. Incentivamos você a tomar decisões de saúde com base em sua pesquisa e parceria com um profissional de saúde qualificado.
Informações do blog e discussões de escopo
Nosso escopo de informações limita-se à Quiropraxia, musculoesquelética, medicamentos físicos, bem-estar, contribuindo distúrbios viscerossomáticos dentro de apresentações clínicas, dinâmica clínica de reflexo somatovisceral associada, complexos de subluxação, questões de saúde sensíveis e/ou artigos, tópicos e discussões de medicina funcional.
Nós fornecemos e apresentamos colaboração clínica com especialistas de várias disciplinas. Cada especialista é regido por seu escopo profissional de prática e sua jurisdição de licenciamento. Usamos protocolos funcionais de saúde e bem-estar para tratar e apoiar o cuidado de lesões ou distúrbios do sistema músculo-esquelético.
Nossos vídeos, postagens, tópicos, assuntos e insights abrangem assuntos clínicos, problemas e tópicos relacionados e apoiam direta ou indiretamente nosso escopo de prática clínica.*
Nosso escritório tentou razoavelmente fornecer citações de apoio e identificou o estudo de pesquisa relevante ou estudos que apóiam nossas postagens. Fornecemos cópias dos estudos de pesquisa de apoio à disposição dos conselhos regulatórios e do público mediante solicitação.
Entendemos que cobrimos questões que requerem uma explicação adicional de como isso pode ajudar em um plano de cuidados ou protocolo de tratamento específico; portanto, para discutir melhor o assunto acima, sinta-se à vontade para perguntar Dr. Alex Jiménez, DC, ou contacte-nos 915-850-0900.
Estamos aqui para ajudar você e sua família.
Bênçãos
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
o email: coach@elpasofunctionalmedicine. com
Licenciado como Doutor em Quiropraxia (DC) em Texas & Novo México*
Licença DC do Texas # TX5807, Novo México DC Licença # NM-DC2182
Licenciada como enfermeira registrada (RN*) in Florida
Licença da Flórida Licença RN # RN9617241 (Controle nº 3558029)
Status compacto: Licença Multiestadual: Autorizado para exercer em Estados 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Meu cartão de visita digital