Todos nós fomos ensinados quando crianças que existem sentidos 5: visão, paladar, som, olfato e tato. Os quatro sentidos iniciais utilizam órgãos claros e distintos, como os olhos, papilas gustativas, orelhas e nariz, mas como o corpo sente o toque exatamente? O toque é experimentado em todo o corpo, tanto dentro como fora. Não há um órgão distinto responsável por sentir o toque. Em vez disso, existem pequenos receptores, ou terminações nervosas, em torno do corpo inteiro, que tocam o sentido onde ocorre e envia sinais ao cérebro com informações sobre o tipo de toque que ocorreu. Como um botão gustativo na língua detecta o sabor, os mecanorreceptores são glândulas dentro da pele e em outros órgãos que detectam sensações de toque. Eles são conhecidos como mecanorreceptores porque eles são projetados para detectar sensações mecânicas ou diferenças de pressão.
Conteúdo
Papel dos mecanorreceptores
Uma pessoa entende que experimentou uma sensação quando o órgão responsável por descobrir esse sentido específico envia uma mensagem ao cérebro, que é o órgão primário que processa e organiza todas as informações. Mensagens são enviadas de todas as áreas do corpo para o cérebro através de fios chamados de neurônios. Existem milhares de pequenos neurônios que se ramificam em todas as áreas do corpo humano, e no final de muitos desses neurônios são mecanorreceptores. Para demonstrar o que acontece quando você toca em um objeto, usamos um exemplo.
Imagine um mosquito pousando em seu braço. A tensão desse inseto, tão leve, estimula os mecanorreceptores naquela área específica do braço. Esses mecanorreceptores enviam uma mensagem ao longo do neurônio ao qual estão conectados. O neurônio conecta todo o caminho ao cérebro, que recebe a mensagem de que algo está tocando seu corpo na localização exata do mecanorreceptor específico que enviou a mensagem. O cérebro vai agir com esse conselho. Talvez diga aos olhos para olhar a região do braço que detectou a assinatura. E quando os olhos dizem ao cérebro que há um mosquito no braço, o cérebro pode dizer à mão para rapidamente afastá-lo. É assim que os mecanorreceptores funcionam. O objetivo do artigo abaixo é demonstrar e discutir detalhadamente a organização funcional e os determinantes moleculares dos mecanorreceptores.
Sentido do Toque: Organização Funcional e Determinantes Moleculares de Receptores Mecanossensíveis
Sumário
Os mecanorreceptores cutâneos estão localizados nas várias camadas da pele, onde detectam uma ampla gama de estímulos mecânicos, incluindo pinceladas leves, alongamentos, vibração e pressão nociva. Esta variedade de estímulos é acompanhada por uma gama diversificada de mecanorreceptores especializados que respondem à deformação cutânea de uma maneira específica e retransmitem esses estímulos para estruturas cerebrais superiores. Estudos entre mecanorreceptores e terminações nervosas sensoriais geneticamente tratáveis estão começando a revelar mecanismos de sensação de toque. O trabalho nesse campo proporcionou aos pesquisadores uma compreensão mais profunda da organização do circuito subjacente à percepção do toque. Novos canais iônicos emergiram como candidatos para moléculas de transdução e propriedades de correntes mecanicamente bloqueadas melhoraram nossa compreensão dos mecanismos de adaptação a estímulos táteis. Esta revisão destaca os progressos realizados na caracterização das propriedades funcionais dos mecanorreceptores em pele e canais iônicos, peludos e glabrosos, que detectam entradas mecânicas e modelam a adaptação dos mecanorreceptores.
Palavras-chave: mecanoreceptor, canal mecanossensitivo, dor, pele, sistema somatossensorial, toque
Introdução
O toque é a detecção de estímulos mecânicos que afetam a pele, incluindo estímulos mecânicos inócuos e nocivos. É um sentido essencial para a sobrevivência e o desenvolvimento de mamíferos e humanos. O contato de objetos sólidos e fluidos com a pele fornece informações necessárias ao sistema nervoso central que permitem a exploração e o reconhecimento do ambiente e inicia a locomoção ou o movimento planejado da mão. O toque também é muito importante para o aprendizado, os contatos sociais e a sexualidade. Senso de toque é o sentido menos vulnerável, embora possa ser distorcido (hiperestesia, hipoestesia) em muitas condições patológicas.1-3
As respostas ao toque envolvem uma codificação muito precisa de informações mecânicas. Os mecanorreceptores cutâneos estão localizados nas várias camadas da pele, onde detectam uma ampla gama de estímulos mecânicos, incluindo escova leve, alongamento, vibração, deflexão do cabelo e pressão nociva. Essa variedade de estímulos é acompanhada por um conjunto diversificado de mecanorreceptores especializados que respondem à deformação cutânea de uma maneira específica e retransmitem esses estímulos para estruturas cerebrais superiores. Os neurônios somatossensoriais da pele se dividem em dois grupos: mecanorreceptores de baixo limiar (LTMRs) que reagem à pressão benigna e mecanorreceptores de alto limiar (HTMRs) que respondem à estimulação mecânica prejudicial. Os corpos celulares LTMR e HTMR residem nos gânglios da raiz dorsal (DRG) e nos gânglios sensoriais cranianos (gânglios trigeminais). As fibras nervosas associadas a LTMRs e HTMRs são classificadas como fibras A? -, A? - ou C com base em suas velocidades de condução do potencial de ação. As fibras C são amielínicas e têm as velocidades de condução mais lentas (~ 2 m / s), enquanto A? e A? as fibras são leve e fortemente mielinizadas, exibindo velocidades de condução intermediárias (~ 12 m / s) e rápidas (~ 20 m / s), respectivamente. Os LTMRs também são classificados como respostas de adaptação lenta ou rápida (SA- e RA-LTMRs) de acordo com suas taxas de adaptação a estímulos mecânicos sustentados. Eles são ainda distinguidos pelos órgãos finais cutâneos que inervam e seus estímulos preferidos.
A habilidade dos mecanorreceptores em detectar sinais mecânicos depende da presença de canais iônicos mecanotransdutores que rapidamente transformam forças mecânicas em sinais elétricos e despolarizam o campo receptivo. Essa despolarização local, chamada potencial receptor, pode gerar potenciais de ação que se propagam em direção ao sistema nervoso central. No entanto, as propriedades das moléculas que mediam a mecanotransdução e a adaptação às forças mecânicas permanecem incertas.
Nesta revisão, fornecemos uma visão geral das propriedades mecanorreceptoras de mamíferos no toque inócuo e nocivo na pele peluda e glabra. Também consideramos o conhecimento recente sobre as propriedades das correntes controladas mecanicamente na tentativa de explicar o mecanismo de adaptação dos mecanorreceptores. Finalmente, revisamos o progresso recente feito na identificação de canais iônicos e proteínas associadas responsáveis pela geração de correntes mecanogated.
Toque inócuo
LTMRs associados ao folículo piloso
Os folículos pilosos representam os mini-órgãos produtores de haste capilar que detectam o toque leve. As fibras associadas aos folículos pilosos respondem ao movimento do cabelo e à sua direção ao disparar trens de potenciais de ação no início e na remoção do estímulo. Eles estão se adaptando rapidamente aos receptores.
Gato e coelho. Na pelagem de gato e coelho, os folículos pilosos podem ser divididos em três tipos de folículos pilosos, o pêlo para baixo, o pêlo de guarda e o Tylotrichs. Os pelos (pêlos, lã, velus) 4 são os mais numerosos, os mais curtos e finos da pelagem. São ondulados, incolores e emergem em grupos de dois a quatro fios de um orifício comum na pele. Os cabelos da Guarda (monotrichs, overhears, tophair) 4 são ligeiramente curvos, pigmentados ou não pigmentados, e emergem individualmente da boca de seus folículos. Os tylotrichs são os menos numerosos, os cabelos mais longos e mais grossos.5,6 Eles são pigmentados ou não, às vezes ambos e emergem individualmente de um folículo que é circundado por uma alça de vasos sanguíneos capilares. O suprimento de fibras sensoriais para um folículo piloso está localizado abaixo da glândula sebácea e são atribuídas a A? ou fibras A? -LTMR.
Em aposição próxima ao pêlo do pêlo, logo abaixo do nível da glândula sebácea está o anel das terminações lanceoladas pilo-Ruffini. Essas terminações nervosas sensitivas são posicionadas em um curso espiral ao redor da haste do cabelo dentro do tecido conectivo que forma o folículo piloso. Dentro do folículo piloso, há também terminações nervosas livres, algumas delas formando mecanorreceptores. Freqüentemente, os corpúsculos de toque (veja a pele glabra) estão cercando a região do pescoço do folículo nódulo.
As propriedades das terminações nervosas mielinizadas na pele peluda de gato e coelho foram exploradas intensamente no período de 1930-1970 (revisão em Hamann, 1995) .8 Notavelmente, Brown e Iggo, estudando 772 unidades com fibras nervosas aferentes mielinizadas nos nervos safenos de gato e coelho, classificaram as respostas em três tipos de receptores correspondentes aos movimentos dos fios de cabelo Down (receptores do tipo D), cabelo de guarda (receptores do tipo G) e cabelo Tylotrich (receptor do tipo T) .9 Todas as respostas das fibras nervosas aferentes foram reunidas no receptor de adaptação rápida do tipo I (RA I) por oposição ao receptor pacinian denominado RA II. Os mecanorreceptores RA I detectam a velocidade do estímulo mecânico e possuem bordas nítidas. Eles não detectam variações térmicas. Burgess et al. também descreveu um receptor de campo que se adapta rapidamente e responde de maneira ideal ao toque da pele ou ao movimento de vários fios de cabelo, o que foi atribuído à estimulação das terminações pilo-Ruffini. Nenhuma das respostas do folículo capilar foi atribuída à atividade da fibra C.10
Ratos. Na pele pilosa dorsal de camundongos, três tipos principais de folículos pilosos foram descritos: ziguezague (em torno de 72%), furador / auchene (em torno de 23%) e guarda ou tylotrich (em torno de 5%). 11-14 Zigzag e Awl / Os folículos capilares da auchenne produzem os fios de cabelo mais finos e mais curtos e estão associados a uma glândula sebácea. Cabelos de guarda ou tylotrich são os mais longos dos tipos de folículos capilares. Eles são caracterizados por um bulbo capilar grande associado a duas glândulas sebáceas. Os pêlos guarda e awl / auchene são dispostos em um padrão iterativo, regularmente espaçado, enquanto os pêlos em ziguezague preenchem densamente as áreas da pele ao redor dos dois tipos maiores de folículos capilares [Fig. 1 (A1, A2 e A3)].
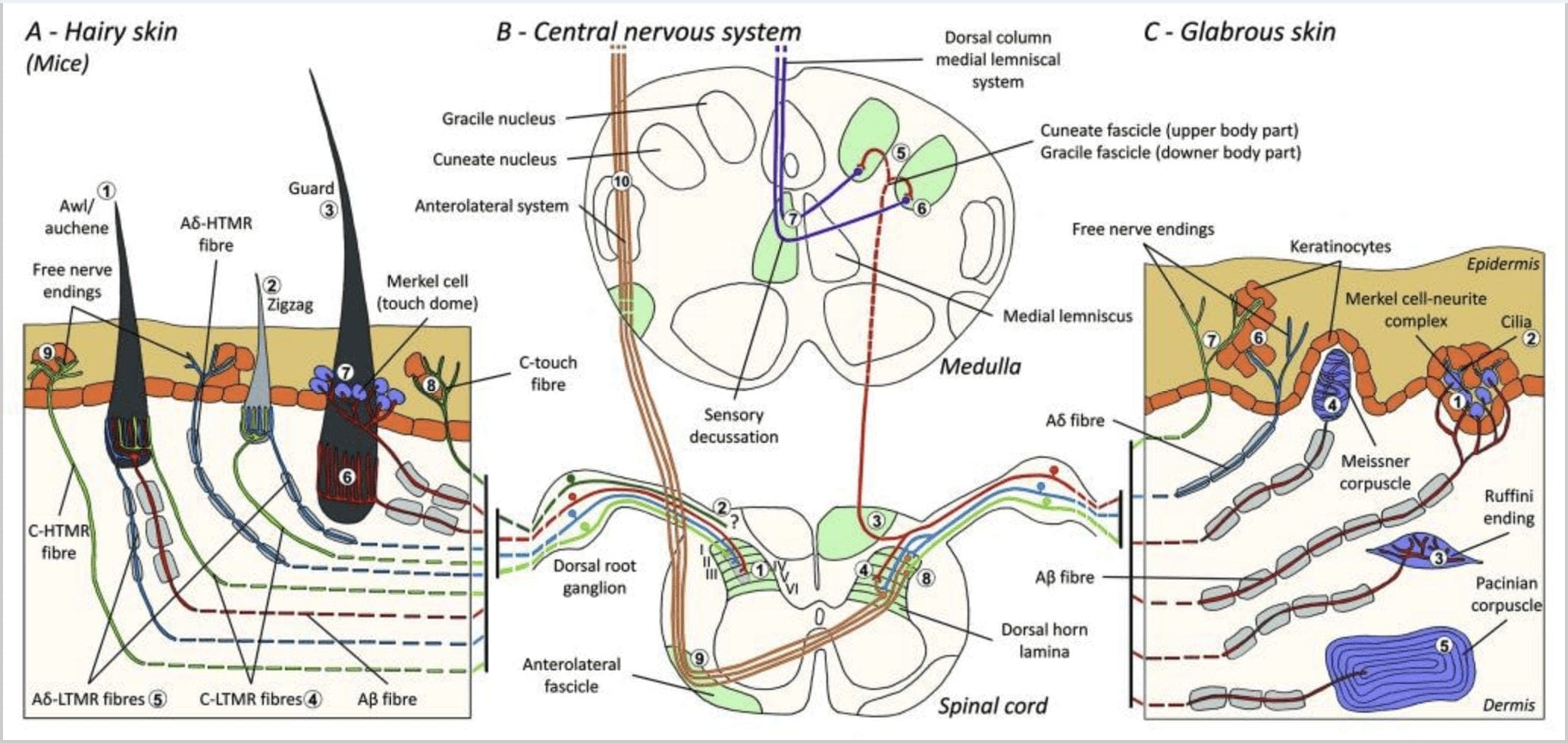
Figura 1. Painel do Organização e projeções de mecanorreceptores cutâneos. Na pele pilosa, a luz e o toque são detectados principalmente pela inervação em torno dos folículos pilosos: awl / auchenne (A1), ziguezague (A2) e guarda (A3). Os cabelos de awl / auchene são triplamente inervados pelas terminações lanceoladas C-LTMR (A4), A? -LTMR e A? adaptando-se rapidamente-LTMR (A6). Os folículos capilares em ziguezague são os fios de cabelo mais curtos e são inervados por C-LTMR (A4) e A? -LTMR terminações lanceoladas (A5). Os folículos capilares mais longos são inervados por A? terminações lanceoladas longitudinais LTMR de adaptação rápida (A6) e estão associadas com A? adaptando-se lentamente-LTMR de terminações de domo de toque (A7). As projeções centrais de todas essas fibras terminam em lâminas distintas, mas parcialmente sobrepostas do corno dorsal da medula espinhal (C-LTMR na lâmina II, A? -LTMR na lâmina III e A? -LTMR na lâmina IV e V). As projeções de LTMR que inervam os folículos pilosos iguais ou adjacentes são alinhadas para formar uma coluna estreita no corno dorsal da medula espinhal (B1 em cinza). Apenas na pele pilosa, uma subpopulação da terminação livre das fibras C inerva a epiderme e responde ao toque agradável (A8). Essas fibras C-touch não respondem ao toque nocivo e sua trajetória de viagem ainda não é conhecida (B2). Na pele glabra, o toque inócuo é mediado por quatro tipos de LTMRs. O complexo neuronal de células de Merkel está na camada basal da epiderme (C1). Este mecanorreceptor consiste em um arranjo entre muitas células de Merkel e um terminal nervoso alargado de um único A? fibra. As células de Merkel exibem processos semelhantes aos dedos em contato com queratinócitos (C2). O final de Ruffini é localizado na derme. É uma fina extremidade sensorial encapsulada em forma de charuto conectada a A? fibra (C3). O corpúsculo de Meissner conectado a A? terminação nervosa e está localizado nas papilas dérmicas. Este mecanorreceptor encapsulado consiste em células de suporte compactadas dispostas como lamelas horizontais circundadas por tecido conjuntivo (C4). O corpúsculo de Pacini é o mecanoreceptor mais profundo. Um único A? A terminação nervosa amielínica termina no centro deste grande corpúsculo ovóide feito de lamelas concêntricas. As projeções dessas fibras A? -LTMR na medula espinhal são divididas em dois ramos. O ramo central principal (B3) sobe na medula espinhal nos fascículos cuneiforme ou fascículos ipsilaterais dorsais (B5) sobre o nível da medula, onde os aferentes primários fazem sua primeira sinapse (B6). Os neurônios secundários fazem uma decussação sensorial (B7) para formar um trato no lemnisco medial que ascende através do tronco cerebral até o mesencéfalo, especificamente no tálamo. A ramificação secundária da LTMR termina no corno dorsal na lâmina II, IV, V e interfere na transmissão da dor (B4). O toque nocivo é detectado pela terminação nervosa livre na epiderme da pele cabeluda (A9) e glabra (C7). Esses mecanorreceptores são a terminação de A? -HTMR e C-HTMR em contato próximo com queratinócitos vizinhos (C6). Um? -HTMR termina na lâmina I e V; C-HTMR termina na lâmina I e II (B8). No nível do corno dorsal da medula espinhal, os aferentes primários HTMRs fazem sinapses com neurônios secundários que cruzam a linha média e sobem para a estrutura cerebral superior no fascículo anterolateral (B9, B10).
Recentemente, Ginty e colaboradores usaram uma combinação de marcação genético-molecular e abordagens de rastreamento retrógrado somatotópico para visualizar a organização das terminações axonais periféricas e centrais dos LTMRs em camundongos.15 Suas descobertas suportam um modelo no qual características individuais de um estímulo tátil complexo são extraído pelos três tipos de folículos capilares e transportado através das atividades de combinações únicas de fibras A? -, A? - e C- para o corno dorsal.
Eles mostraram que a marcação genética de neurônios DRG tirosina hidroxilase positivos (TH +) caracterizam uma população de neurônios sensoriais não peptidérgicos de pequeno diâmetro e permitem a visualização de terminações periféricas C-LTMR na pele. Surpreendentemente, verificou-se que os ramos axoneais de C-LTMRs individuais se arborizam e formam terminações lanceoladas longitudinais que estão intimamente associadas com ziguezague (80% das terminações) e furador / aucheno (20% das terminações), mas não folículos pilosos de tilotrich [Fig. 1 (A4)]. Há muito tempo se pensa que terminações lanceoladas longitudinais pertencem exclusivamente a A? -LTMRs e, portanto, era inesperado que as terminações de C-LTMRs formassem terminações lanceoladas longitudinais.15 Esses C-LTMRs têm uma adaptação intermediária em comparação com a adaptação lenta e rápida mecanorreceptores mielinizados [Fig. 2 (C1)].
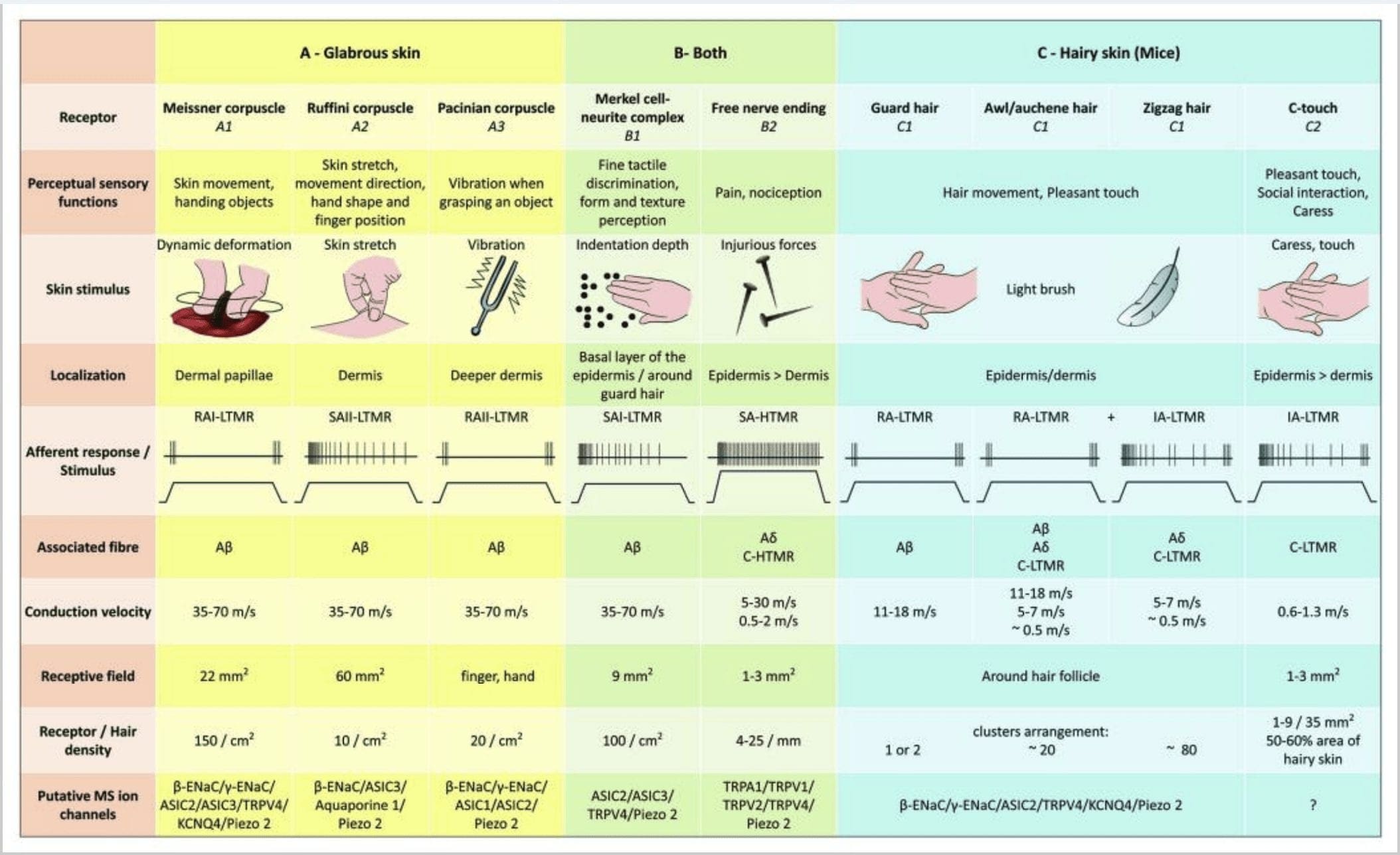
Figura 2. Painel do Receptores táteis em mamíferos: Os receptores táteis cutâneos se diferenciam em toque inócuo apoiado por múltiplos receptores com baixo limiar mecânico (LTMRs) em pele glabra e cabeluda e toque nocivo suportado por receptor de alto limiar mecânico (HTMRs). Eles constituem terminações livres de nervos que terminam principalmente na epiderme. (A) Pele glabra. A1: Os corpúsculos de Meissner detectam o movimento da pele e o deslizamento de objetos na mão. Eles são importantes para manusear objetos e destreza. Os receptores se adaptam rapidamente ao estímulo, são conectados a A? fibras e esparsamente às fibras C e têm grande campo receptor. A2: Os corpúsculos de Ruffini detectam o estiramento da pele e são importantes para detectar a posição do dedo e o objeto de mão. O receptor se adapta lentamente ao estímulo e mantém a atividade enquanto o estímulo é aplicado. Os receptores estão conectados a A? fibras e têm grande campo receptivo. A3: os corpúsculos pacinianos estão mais profundos na derme e detectam vibração. Os receptores estão conectados a A? fibras; eles se adaptam rapidamente ao estímulo e têm o maior campo receptivo. (B) Pele inteira. B1: Os complexos de células de Merkel estão presentes na pele glabra e ao redor do cabelo. Eles são densamente expressos na mão e são importantes para a percepção da textura e a melhor discriminação entre dois pontos. Eles são responsáveis pela precisão dos dedos. Os receptores estão conectados a A? fibras; eles se adaptam lentamente ao estímulo e têm campo receptivo curto. B2: HTMRs de toque nocivo com adaptação muito lenta ao estímulo, ou seja, ativo enquanto o estímulo nociceptivo for aplicado. Eles são formados pela terminação nervosa livre de A? e fibras C associadas a queratinócitos. (C) Pele com pelos. C1: Os folículos capilares estão associados aos diferentes tipos de cabelo. Em camundongos, os pêlos Guard são os mais longos e esparsamente expressos, os pêlos furadores / auchenne são de tamanho médio e os em zigue-zague são os menores e mais densamente expressos. Eles estão conectados a A? fibras, mas também para A? e fibras C-LTMRs para cabelo furador / auchenne e zizag. Eles detectam o movimento do cabelo, incluindo um toque agradável durante a carícia. Eles se adaptam rapidamente ou com cinética intermediária ao estímulo. C2: As terminações nervosas C-touch correspondem a um subtipo de terminação das fibras C com terminação livre caracterizada por um baixo limiar mecânico. Eles deveriam codificar para a sensação agradável induzida por carícia. Eles se adaptam moderadamente ao estímulo e têm campo receptivo curto. Os canais de íons mecanossensíveis putativos (MS) expressos nos diferentes receptores táteis são indicados de acordo com os dados preliminares e resumem a presente hipótese sob avaliação.
Uma segunda grande população identificada refere-se às terminações A <0.07> -LTMR em Awl / Auchenne e folículos em ziguezague a serem comparados com o folículo piloso de Down extensivamente estudado em gato e coelho. Ginty e colaboradores mostraram que TrkB é expresso em níveis elevados em um subconjunto de neurônios DRG de diâmetro médio. Registros intracelulares usando a preparação de nervo cutâneo ex vivo de fibras marcadas revelaram que elas exibem as propriedades fisiológicas das fibras previamente estudadas em gatos e coelhos: sensibilidade mecânica requintada (limiar de Von Frey <5.8 mN), respostas de adaptação rápida a estímulos supralimiares, condução intermediária velocidades (0.9 ± 15 m / s) e pontas estreitas do soma não flexionadas.1 Esses A? -LTMRs formam terminações lanceoladas longitudinais associadas a virtualmente todos os folículos pilosos em zigue-zague e furador / aucheno do tronco [Fig. 5 (AXNUMX)].
Finalmente, eles mostraram que as terminações periféricas de adaptação rápida de A? Os LTMRs formam terminações lanceoladas longitudinais associadas aos folículos pilosos de guarda (ou tylotrich) e furador / aucheno [Fig. 1 (A6)]. 15 Além disso, os cabelos Guard também estão associados a um complexo de células de Merkel formando uma cúpula de toque conectada a A? adaptando lentamente o LTMR [Fig. 1 (A7)].
Em resumo, virtualmente todos os folículos pilosos em ziguezague são inervados por terminações lanceoladas C-LTMR e A? -LTMR; os cabelos do furador / aucheno são triplamente inervados por A? terminações lanceoladas de adaptação rápida-LTMR, A? -LTMR e C-LTMR; Os folículos capilares são inervados por A? terminações lanceoladas longitudinais LTMR de adaptação rápida e interagem com A? adaptando-se lentamente-LTMR de terminações de cúpula de toque. Assim, cada folículo capilar de camundongo recebe combinações únicas e invariantes de terminações LTMR correspondentes a órgãos terminais mecanossensoriais neurofisiologicamente distintos. Considerando o arranjo iterativo desses três tipos de cabelo, Ginty e colaboradores propõem que a pele cabeluda consiste em uma repetição iterativa de unidade periférica contendo, (1) um ou dois fios de guarda localizados centralmente, (2) ~ 20 fios de furador / auchenne circundantes e (3 ) ~ 80 fios de cabelo em zigue-zague intercalados [Fig. 2 (C1)].
Projeção da medula espinhal. As projeções centrais de A? LTMRs de adaptação rápida, A? -LTMRs e C-LTMRs terminam em lâminas distintas, mas parcialmente sobrepostas (II, III, IV) do corno dorsal da medula espinhal. Além disso, os terminais centrais dos LTMRs que inervam os mesmos folículos pilosos ou adjacentes dentro de uma unidade LTMR periférica estão alinhados para formar uma coluna estreita do LTMR no corno dorsal da medula espinhal [Fig. 1 (B1)]. Assim, parece provável que uma cunha ou coluna de terminações aferentes sensoriais primárias organizadas somatotopicamente no corno dorsal represente o alinhamento das projeções centrais de A? -, A? - e C-LTMRs que inervam a mesma unidade periférica e detectam mecânica estímulos agindo sobre o mesmo pequeno grupo de folículos capilares. Com base no número de pêlos de guarda, furador / aucheno e ziguezague do tronco e membros e os números de cada subtipo LTMR, Ginty e colaboradores estimam que o corno dorsal do camundongo contém 2,000 4,000 colunas LTMR, o que corresponde ao número aproximado de colunas LTMR Unidades LTMR. 15
Além disso, os axônios dos subtipos de LTMR estão intimamente associados uns aos outros, tendo projeções entrelaçadas e terminações lanceoladas interdigitadas que inervam o mesmo folículo piloso. Além disso, como os três tipos de folículos capilares exibem diferentes formas, tamanhos e composições celulares, é provável que tenham propriedades distintas de ajuste de deflexão ou vibracional. Esses achados são consistentes com as medições neurofisiológicas clássicas em gatos e coelhos, indicando que A? RA-LTMRs e A? -LTMRs podem ser diferencialmente ativados por deflexão de tipos distintos de folículos capilares.16,17
Em conclusão, o toque na pele pilosa é a combinação de: (1) os números relativos, distribuições espaciais únicas e propriedades morfológicas e defletivas distintas dos três tipos de folículos pilosos; (2) as combinações únicas de terminações de subtipos de LTMR associadas a cada um dos três tipos de folículos capilares; e (3) sensibilidades distintas, velocidades de condução, padrões de trem de pico e propriedades de adaptação das quatro principais classes de LTMR associadas ao folículo piloso que permitem ao sistema mecanossensorial da pele pilosa extrair e transmitir ao SNC as complexas combinações de qualidades que definem um tocar.
Terminais de Nervos Livres LTMRs
Geralmente, as terminações livres das fibras C na pele são HTMRs, mas uma subpopulação de fibras C não responde ao toque nocivo. Este subconjunto de aferentes táteis de fibra C (CT) representa um tipo distinto de unidades mecanorreceptivas não mielinizadas de baixo limiar existentes na pele peluda, mas não glabra de humanos e mamíferos [Fig. 1 (A8)]. 18,19 As TCs geralmente estão associadas à percepção de estimulação tátil agradável no contato corporal.20,21
Os aferentes de TC respondem a forças de indentação na faixa de 0.3 ± 2.5 mN e, portanto, são tão sensíveis à deformação da pele quanto muitos dos A? aferentes.19 As características de adaptação dos aferentes TC são, portanto, intermediárias em comparação com os mecanorreceptores mielinizados de adaptação lenta e rápida. Os campos receptivos dos aferentes tomográficos humanos são aproximadamente redondos ou de formato oval. O campo consiste em um a nove pequenos pontos responsivos distribuídos por uma área de até 35 mm2.22 Os receptores homólogos de camundongos são organizados em um padrão de manchas descontínuas cobrindo cerca de 50-60% da área da pele com pelos [Fig. 2 (C2)]. 23
Evidências de pacientes sem aferentes tátil mielinizados indicam que a sinalização em fibras CT ativa o córtex insular. Uma vez que este sistema é pobre em codificar aspectos discriminativos do toque, mas bem adaptado para codificar o toque lento e suave, as fibras CT na pele peluda podem ser parte de um sistema para processar aspectos agradáveis e socialmente relevantes do toque. A ativação da fibra 24 CT também pode têm um papel na inibição da dor e foi recentemente proposto que a inflamação ou o trauma podem alterar a sensação transmitida pelas LTMRs de fibra C, do toque agradável à dor.25,26
Que viagem de CT-aferentes de caminho ainda não é conhecida [Fig. 1 (B2)], mas entradas tátil de baixo limiar para células de projeção espinotalâmicos foram documentadas, 27 dando crédito a relatos de déficits sutis e contralaterais de detecção de toque em pacientes humanos após a destruição dessas vias após procedimentos de cordotomia.28
LTMRs em pele glabra
Complexos de células-neurite de Merkel e toque domo. Merkel (1875) foi o primeiro a dar uma descrição histológica de aglomerados de células epidérmicas com grandes núcleos lobulados, fazendo contato com supostas fibras nervosas aferentes. Ele presumiu que eles serviam ao tato ao chamá-los de Tastzellen (células táteis). Em humanos, os complexos de neurita de célula de Merkel são enriquecidos em áreas da pele sensíveis ao toque, eles são encontrados na camada basal da epiderme nos dedos, lábios e genitais. Eles também existem na pele cabeluda em densidade mais baixa. O complexo neurítico de célula de Merkel consiste em uma célula de Merkel em estreita aposição a um terminal nervoso aumentado de um único A? fibra [Fig. 1 (C1)] (revisão em Halata e colaboradores) .29 No lado epidérmico, a célula de Merkel exibe processos semelhantes a dedos que se estendem entre queratinócitos vizinhos [Fig. 1 (C2)]. As células de Merkel são células epidérmicas derivadas de queratinócitos.30,31 O termo cúpula de toque foi introduzido para denominar a grande concentração de complexos de células de Merkel na pele peluda da pata dianteira do gato. Uma cúpula de toque poderia ter até 150 células Merkel inervadas por uma única fibra A? E em humanos além das fibras A?, A? e fibras C também estavam regularmente presentes.32-34
A estimulação dos complexos de neurita de célula de Merkel resulta em respostas de adaptação lenta do Tipo I (SA I), que se originam de campos receptivos pontilhados com bordas nítidas. Não há descarga espontânea. Esses complexos respondem à profundidade de indentação da pele e têm a maior resolução espacial (0.5 mm) dos mecanorreceptores cutâneos. Eles transmitem uma imagem espacial precisa de estímulos táteis e são propostos como responsáveis pela discriminação de forma e textura [Fig. 2 (B1)]. Camundongos desprovidos de células Merkel não podem detectar superfícies texturizadas com seus pés enquanto o fazem usando seus bigodes.35
Se a célula de Merkel, o neurônio sensorial ou ambos são locais de mecanotransdução ainda é uma questão de debate. Em ratos, a destruição fototóxica de células Merkel abole a resposta SA I.36 Em camundongos com células Merkel geneticamente suprimidas, a resposta SA I registrada na preparação de pele / nervo ex vivo desapareceu completamente, demonstrando que as células Merkel são necessárias para a codificação adequada de Merkel respostas do receptor.37 No entanto, a estimulação mecânica de células de Merkel isoladas em cultura por pressão motora não gera correntes bloqueadas mecanicamente.38,39 Os queratinócitos podem desempenhar um papel importante no funcionamento normal do complexo neurito-célula de Merkel. Os processos semelhantes aos dos dedos das células de Merkel podem se mover com a deformação da pele e o movimento das células da epiderme, e esta pode ser a primeira etapa da transdução mecânica. Claramente, as condições necessárias para estudar a sensibilidade mecânica das células de Merkel ainda não foram estabelecidas.
Terminações de Ruffini. As terminações Ruffini são finas terminações sensoriais encapsuladas em forma de charuto conectadas a A? terminações nervosas. As terminações de Ruffini são pequenos cilindros de tecido conjuntivo dispostos ao longo dos filamentos de colágeno dérmico que são fornecidos por uma a três fibras nervosas mielinizadas de 4 6 m de diâmetro. Até três cilindros de orientação diferente na derme podem se fundir para formar um receptor [Fig. 1 (C3)]. Estruturalmente, as terminações de Ruffini são semelhantes aos órgãos tendinosos de Golgi. Eles são amplamente expressos na derme e foram identificados como os mecanorreceptores cutâneos de adaptação lenta do tipo II (SA II). Contra o pano de fundo da atividade nervosa espontânea, uma descarga regular de adaptação lenta é provocada por uma baixa força perpendicular mantida por estimulação mecânica ou, mais efetivamente, por alongamento dérmico. A resposta SA II origina-se de grandes campos receptivos com bordas obscuras. Os receptores Ruffini contribuem para a percepção da direção do movimento do objeto através do padrão de estiramento da pele [Fig. 2 (A2)].
Em camundongos, as respostas SA I e SA II podem ser separadas eletrofisiologicamente na preparação de pele nervosa ex-vivo.40 Nandasena e colaboradores relataram a imunolocalização da aquaporina 1 (AQP1) nas terminações periodontais de Ruffini dos incisivos de ratos, sugerindo que o AQP1 está envolvido a manutenção do equilíbrio osmótico dental necessário para a mecanotransdução.41 As terminações periodontais de Ruffini também expressaram o putativo canal iônico mecanossensitivo ASIC3.42
Corpúsculos Meissner. Os corpúsculos de Meissner estão localizados nas papilas dérmicas da pele glabra, principalmente nas palmas das mãos e solas dos pés, mas também nos lábios, na língua, no rosto, nos mamilos e nos genitais. Anatomicamente, eles consistem em uma terminação nervosa encapsulada, a cápsula sendo feita de células de suporte achatadas dispostas como lamelas horizontais embutidas no tecido conjuntivo. Existe uma única fibra nervosa A? aferentes conectados por corpúsculo [Fig. 1 (C4)]. Qualquer deformação física do corpúsculo desencadeia uma saraivada de potenciais de ação que cessa rapidamente, ou seja, são receptores de adaptação rápida. Quando o estímulo é removido, o corpúsculo recupera sua forma e, ao fazer isso, produz outra saraivada de potenciais de ação. Devido à sua localização superficial na derme, esses corpúsculos respondem seletivamente ao movimento da pele, detecção tátil de escorregamento e vibrações (20 40 Hz). Eles são sensíveis à pele dinâmica - por exemplo, entre a pele e um objeto que está sendo manuseado [Fig. 2 (A1)].
Corpúsculos de Pacini. Os corpúsculos pacinianos são os mecanorreceptores mais profundos da pele e são os mecanorreceptores cutâneos encapsulados mais sensíveis do movimento da pele. Esses grandes corpúsculos ovóides (1 mm de comprimento) feitos de lamelas concêntricas de tecido conjuntivo fibroso e fibroblastos revestidos por células de Schwann modificadas planas são expressos na derme profunda.43 No centro do corpúsculo, em uma cavidade cheia de líquido chamada bulbo interno , termina um único A? terminação nervosa aferente não mielinizada [Fig. 1 (C5)]. Eles têm um grande campo receptivo na superfície da pele com um centro particularmente sensível. O desenvolvimento e a função de vários tipos de mecanorreceptores de adaptação rápida são interrompidos em camundongos mutantes c-Maf. Em particular, os corpúsculos pacinianos estão severamente atrofiados.44
Os corpúsculos de Paciniano apresentam uma adaptação muito rápida em resposta à indentação da pele, a descarga nervosa II (RA II) de adaptação rápida que é capaz de seguir uma alta frequência de estímulos vibratórios e permite a percepção de eventos distantes por meio de vibrações transmitidas.45 Corpúsculo de Paciniano os aferentes respondem ao recuo sustentado com atividade transitória no início e no fim do estímulo. Eles também são chamados de detectores de aceleração porque podem detectar mudanças na força do estímulo e, se a taxa de mudança no estímulo for alterada (como acontece nas vibrações), sua resposta torna-se proporcional a essa mudança. Os corpúsculos de Paciniano sentem mudanças brutas de pressão e, principalmente, vibrações (150 300 Hz), que podem detectar até mesmo centímetros de distância [Fig. 2 (A3)].
A resposta tônica foi observada no corpúsculo Pacini decapsulado.46 Além disso, os corpúsculos de Pacini intactos respondem com atividade sustentada durante estímulos de indentação constante, sem alterar os limiares mecânicos ou a frequência de resposta quando a sinalização mediada por GABA é bloqueada entre a glia lamelar e uma terminação nervosa.47 os componentes não neuronais do corpúsculo de Pacinian podem ter dois papéis na filtragem do estímulo mecânico, bem como na modulação das propriedades de resposta do neurônio sensorial.
Projeções da medula espinhal. As projeções dos A? -LTMRs na medula espinhal são divididas em dois ramos. O ramo central principal sobe na medula espinhal nas colunas dorsais ipsilaterais até o nível cervical [Fig. 1 (B3)]. Ramos secundários terminam no corno dorsal na lâmina IV e interferem na transmissão da dor, por exemplo. Isso pode atenuar a dor como parte do controle do portão [Fig. 1 (B4)]. 48
Nos níveis cervicais, os axônios do ramo principal se separam em dois tratos: o trato da linha média compreende o fascículo grácil que transporta informações da metade inferior do corpo (pernas e tronco) e o trato externo compreende o fascículo cuneiforme que transmite informações da metade superior. do corpo (braços e tronco) [Fig. 1 (B5)].
Os aferentes táteis primários fazem sua primeira sinapse com os neurônios de segunda ordem na medula, onde as fibras de cada trato fazem sinapses em um núcleo de mesmo nome: os axônios do fascículo grácil fazem sinapses no núcleo grácil e os axônios cuneados fazem sinapses no núcleo cuneiforme [Fig. 1 (B6)]. Os neurônios que recebem a sinapse fornecem as aferências secundárias e cruzam a linha média imediatamente para formar um trato no lado contralateral do tronco cerebral - o lemnisco medial - que sobe através do tronco cerebral para a próxima estação de retransmissão no mesencéfalo, especificamente, no tálamo [Fig . 1 (B7)].
Especificação molecular de LTMRs. Os mecanismos moleculares que controlam a diversificação inicial de LTMRs foram parcialmente elucidados recentemente. Bourane e colaboradores mostraram que as populações neuronais que expressam o receptor Ret tirosina quinase (Ret) e seu co-receptor GFR? 2 em camundongos embrionários E11 13 DRG coexpressam seletivamente o fator de transcrição Mafa.49,50 Esses autores demonstram que o Mafa / Neurônios Ret / GFR? 2 destinados a se tornarem três tipos específicos de LTRMs no nascimento: os neurônios SA1 que inervam os complexos de células de Merkel, os neurônios de adaptação rápida que inervam os corpúsculos de Meissner e os aferentes de adaptação rápida (RA I) que formam terminações lanceoladas ao redor dos folículos capilares. Ginty e colaboradores também relatam que os neurônios DRG que expressam Ret inicial estão se adaptando rapidamente a mecanorreceptores de corpúsculos de Meissner, corpúsculos de Paciniana e terminações lanceoladas ao redor dos folículos capilares.51 Eles inervam zonas-alvo discretas dentro dos núcleos grácil e cuneiforme, revelando um padrão específico de modalidade de mecanossensorial projeções axonais de neurônios dentro do tronco cerebral.
Exploração de mecanorreceptores da pele humana. A técnica de microneurografia descrita por Hagbarth e Vallbo em 1968 foi aplicada para estudar o comportamento de descarga de terminações mecanossensíveis humanas únicas que fornecem músculo, articulação e pele (ver para revisão Macefield, 2005) .52,53 A maioria da microneurografia de pele humana estudos têm caracterizado a fisiologia das aferências táteis na pele glabra da mão. Gravações de microeletrodos dos nervos mediano e ulnar em seres humanos revelaram a sensação de toque gerada pelas quatro classes de LTMRs: os aferentes de Meissner são particularmente sensíveis ao toque leve na pele, respondendo a forças de cisalhamento locais e deslizamentos incipientes ou evidentes dentro do campo receptivo. Os aferentes pacinianos são extremamente sensíveis a transientes mecânicos rápidos. Os aferentes respondem vigorosamente ao sopro sobre o campo receptivo. Um corpúsculo paciniano localizado em um dedo geralmente responde ao bater na mesa que sustenta o braço. Os aferentes Merkel têm caracteristicamente uma alta sensibilidade dinâmica aos estímulos de indentação aplicados a uma área discreta e geralmente respondem com uma descarga durante a liberação. Embora os aferentes Ruffini respondam às forças aplicadas normalmente à pele, uma característica única dos aferentes SA II é sua capacidade de responder também ao estiramento lateral da pele. Finalmente, as unidades de cabelo no antebraço têm grandes campos ovóides ou receptivos irregulares compostos de vários pontos sensíveis que correspondiam a cabelos individuais (cada fonte aferente ~ 20 fios de cabelo).
Sensibilidade Mecânica dos Queratinócitos
Qualquer estímulo mecânico na pele deve ser transmitido através dos queratinócitos que formam a epiderme. Essas células onipresentes podem desempenhar funções de sinalização além de seus papéis de suporte ou proteção. Por exemplo, os queratinócitos secretam ATP, uma importante molécula de sinalização sensorial, em resposta a estímulos mecânicos e osmóticos.54,55 A liberação de ATP induz o aumento do cálcio intracelular pela estimulação autócrina dos receptores purinérgicos.55 Além disso, há evidências de que a hipotonicidade ativa a Rho-quinase. via de sinalizao e a subsequente formao de fibras de stress de F-actina, sugerindo que a deformao mecica dos queratinitos pode interferir mecanicamente com as culas vizinhas, tais como culas de Merkel para toque ino e extremidades isentas de fibra C para toque nocivo [Fig. 1 (C6)]. 56,57
Toque nocivo
Os mecanorreceptores de alto limiar (HTMRs) são C- e A? terminações nervosas livres. Eles não estão associados a estruturas especializadas e são observados em ambas as peles com pelos [Fig. 1 (A9)] e pele glabra [Fig. 1 (C7)]. No entanto, o termo terminação nervosa livre deve ser considerado com cautela, uma vez que as terminações nervosas estão sempre em estreita aposição com queratinócitos ou células de Langherans ou melanócitos. A análise ultraestrutural das terminações nervosas revela a presença de retículo endoplasmático rugoso, mitocôndrias abundantes e vesícula de núcleo denso. As membranas adjacentes das células epidérmicas são espessadas e se assemelham à membrana pós-sináptica nos tecidos nervosos. Observe que as interações entre as terminações nervosas e as células epidérmicas podem ser bidirecionais, uma vez que as células epidérmicas podem liberar mediadores como ATP, interleucina (IL6, IL10) e bradicinina e, inversamente, as terminações nervosas peptidérgicas podem liberar peptídeos como CGRP ou substância P atuando nas células epidérmicas. Os HTMRs compreendem nociceptores mecânicos excitados apenas por estímulos mecânicos nocivos e nociceptores polimodais que também respondem ao calor nocivo e substâncias químicas exógenas [Fig. 2 (B2)]. 58
As fibras aferentes HTMR terminam nos neurônios de projeção no corno dorsal da medula espinhal. Os A? -HTMRs contatam os neurônios de segunda ordem predominantemente na lâmina I e V, enquanto os C-HTMRs terminam na lâmina II [Fig. 1 (B8)]. Neurônios nociceptivos de segunda ordem projetam-se para o lado contralateral da medula espinhal e ascendem na substância branca, formando o sistema ântero-lateral. Esses neurônios terminam principalmente no tálamo [Fig. 1 (B9 e B10)].
Mecano-Correntes em Neurônios Somatosensoriais
Os mecanismos de adaptação lenta ou rápida dos mecanorreceptores ainda não foram elucidados. Não está claro até que ponto a adaptação dos mecanorreceptores é fornecida pelo ambiente celular da extremidade sensitiva do nervo, as propriedades intrínsecas dos canais mecanicamente controlados e as propriedades dos canais iônicos dependentes de voltagem axonal em neurônios sensoriais (Fig. 2). No entanto, progressos recentes na caracterização de correntes controladas mecanicamente demonstraram que existem diferentes classes de canais mecanossensíveis em neurônios DRG e podem explicar alguns aspectos da adaptação de mecanorreceptores.
O registro in vitro em roedores mostrou que a soma dos neurônios DRG é intrinsecamente mecanossensível e expressa correntes catiônicas mecanocaptadas.59-64 Gadolínio e vermelho de rutênio bloqueiam totalmente as correntes mecanossensíveis, enquanto cálcio externo e magnésio, em concentrações fisiológicas, bem como amilorida e benzamil, causam bloqueio parcial.60,62,63 FM1-43 atua como um bloqueador duradouro, e a injeção de FM1-43 na pata traseira de camundongos diminui a sensibilidade à dor no teste Randall Selitto e aumenta o limite de retirada da pata avaliado com cabelos de von Frey. 65
Em resposta à estimulação mecânica sustentada, as correntes mecanossensíveis diminuem durante o fechamento. Com base nas constantes de tempo de queda de corrente, quatro tipos distintos de correntes mecanossensíveis foram distinguidos: correntes de adaptação rápida (~ 3 6 ms), correntes de adaptação intermediária (~ 15 30 ms), correntes de adaptação lenta (~ 200 300 ms) ) e correntes de adaptação ultra-lenta (~ 1000 ms) .64 Todas essas correntes estão presentes com incidência variável em neurônios DRG de rato que inervam a pele glabra da pata traseira. 64
A sensibilidade mecânica das correntes mecanossensíveis pode ser determinada pela aplicação de uma série de estímulos mecânicos incrementais, permitindo uma análise relativamente detalhada do estímulo-corrente.66 A relação da corrente do estímulo é tipicamente sigmoidal, e a amplitude máxima da corrente é determinada pelo número de canais que são abertos simultaneamente.64,67 Curiosamente, a corrente mecanossensível de adaptação rápida foi relatada para exibir baixo limiar mecânico e ponto médio de meia ativação em comparação com a corrente mecanossensível de adaptação ultra-lenta.63,65
Neurônios sensoriais com fenótipos não nociceptivos preferencialmente expressam correntes mecanossensitivas de adaptação rápida com menor limiar mecânico. 60,61,63,64,68 Por outro lado, correntes mecanossensitivas de adaptação lenta e ultra-lenta são ocasionalmente relatadas em células não nociceptivas putativas. 64,68 Isso levou a sugerir que essas correntes podem contribuir para a diferentes limiares mecânicos observados em LTMRs e HTMRs in vivo. Embora esses experimentos in vitro devam ser tomados com cautela, o suporte para a presença no soma dos neurônios do GRD de mecanotransdutores de baixo e alto limiar também foi fornecido pela estimulação baseada no estiramento radial de neurônios sensoriais de ratos cultivados.69 Este paradigma revelou dois Principais populações de neurônios sensíveis ao estiramento, uma que responde à baixa amplitude de estímulo e outra que responde seletivamente à alta amplitude de estímulo.
Esses resultados têm implicações mecanicistas importantes, ainda que especulativas: o limiar mecânico dos neurônios sensoriais pode ter pouco a ver com a organização celular do mecanorreceptor, mas pode estar nas propriedades dos canais iônicos mecanicamente bloqueados.
Os mecanismos que fundamentam a dessensibilização das correntes catiônicas mecanossensíveis em neurônios DRG de ratos foram recentemente desvendados.64,67 Isso resulta de dois mecanismos concorrentes que afetam as propriedades do canal: adaptação e inativação. A adaptação foi relatada pela primeira vez em estudos de células ciliadas auditivas. Pode ser descrito operacionalmente como uma simples tradução da curva de ativação do canal do transdutor ao longo do eixo do estímulo mecânico.70-72 A adaptação permite que os receptores sensoriais mantenham sua sensibilidade a novos estímulos na presença de um estímulo existente. No entanto, uma fração substancial das correntes mecanossensíveis em neurônios DRG não pode ser reativada após o condicionamento da estimulação mecânica, indicando a inativação de alguns canais do transdutor.64,67 Portanto, tanto a inativação quanto a adaptação atuam em conjunto para regular as correntes mecanossensíveis. Esses dois mecanismos são comuns a todas as correntes mecanossensíveis identificadas em neurônios DRG de rato, sugerindo que elementos físico-químicos relacionados determinam a cinética desses canais.64
Em conclusão, determinar as propriedades de correntes endógenas mecanossensíveis in vitro é crucial na busca de identificar mecanismos de transdução em nível molecular. A variabilidade observada no limiar mecânico e na cinética de adaptação das diferentes correntes bloqueadas mecanicamente em neurônios DRG sugerem que as propriedades intrínsecas dos canais iônicos podem explicar, pelo menos em parte, o limiar mecânico e a cinética de adaptação dos mecanorreceptores descritos nas décadas de 1960 80 usando preparações ex vivo.
Proteínas mecanossensíveis putativas
Correntes iônicas mecanossensíveis em neurônios somatossensoriais são bem caracterizadas, em contraste, pouco se sabe sobre a identidade de moléculas que mediam a mecanotransdução em mamíferos. Triagens genéticas em Drosophila e C. elegans identificaram moléculas candidatas de mecanotransdução, incluindo as famílias TRP e degenerina / canal epitelial Na + (Deg / ENaC). 73 Tentativas recentes para elucidar as bases moleculares da mecanotransdução em mamíferos têm se concentrado em grande parte nos homólogos desses candidatos. . Além disso, muitos desses candidatos estão presentes em mecanorreceptores cutâneos e neurônios somatossensoriais (Fig. 2).
Canais Ion Sensores de Ácido
ASICs pertencem a um subgrupo proton-gated da família degenerin epitelial de canais de Na +.74 Três membros da família ASIC (ASIC1, ASIC2 e ASIC3) são expressos em mecanorreceptores e nociceptores. O papel dos canais ASIC foi investigado em estudos comportamentais usando camundongos com deleção direcionada de genes do canal ASIC. A exclusão de ASIC1 não altera a função dos mecanorreceptores cutâneos, mas aumenta a sensibilidade mecânica dos aferentes que inervam o intestino.75 Camundongos nocaute de ASIC2 exibem uma sensibilidade diminuída de adaptação rápida de LTMR cutâneos.76 No entanto, estudos subsequentes relataram uma falta de efeitos de nocaute de ASIC2 em tanto a mecano-nocicepção visceral quanto a mecanosensação cutânea.77 A interrupção do ASIC3 diminui a sensibilidade mecânica dos aferentes viscerais e reduz as respostas de HTMRs cutâneos a estímulos nocivos.76
O canal do receptor transiente
A superfamília TRP é subdividida em seis subfamílias em mamíferos.78 Quase todas as subfamílias TRP têm membros ligados à mecanossensibilização em uma variedade de sistemas celulares.79 Em neurônios sensoriais de mamíferos, no entanto, os canais TRP são mais conhecidos por detectar informações térmicas e mediar a inflamação neurogênica, e apenas dois canais TRP, TRPV4 e TRPA1, foram implicados na capacidade de resposta ao toque. A interrupção da expressão de TRPV4 em camundongos tem apenas efeitos modestos em limiares mecanossensoriais agudos, mas reduz fortemente a sensibilidade a estímulos mecânicos nocivos. O80,81 TRPV4 é um determinante crucial na modelagem da resposta de neurônios nociceptivos ao estresse osmótico e à hiperalgesia mecânica durante a inflamação.82,83 TRPA1 parece tem um papel na hiperalgesia mecânica. Camundongos deficientes em TRPA1 exibem hipersensibilidade à dor. O TRPA1 contribui para a transdução de estímulos mecânicos, frios e químicos em neurônios sensoriais do nociceptor, mas parece que não é essencial para a transdução de células capilares.84,85
Não há evidências claras indicando que canais TRP e canais ASIC expressos em mamíferos sejam mecanicamente bloqueados. Nenhum desses canais expressos de forma heteróloga recapitula a assinatura elétrica das correntes mecanossensitivas observadas em seu ambiente nativo. Isto não exclui a possibilidade de que os canais de ASIC e TRP sejam mecanotransdutores, dada a incerteza de se um canal de mecanotransdução pode funcionar fora de seu contexto celular (ver seção sobre SLP3).
Proteínas Piezo
Os protoens piezoelétricos foram recentemente identificados como candidatos promissores para proteínas de mecanossensibilização por Coste e colaboradores. Os vertebrados 86,87 possuem dois membros Piezo, Piezo 1 e Piezo 2, anteriormente conhecidos como FAM38A e FAM38B, respectivamente, que são bem conservados ao longo de eucariotos multicelulares. Piezo 2 é abundante em DRGs, enquanto Piezo 1 é dificilmente detectável. Correntes mecanossensitivas induzidas por piezo são inibidas por gadolínio, rutênio vermelho e GsMTx4 (uma toxina da tarântula Grammostola spatulata) .88 A expressão de Piezo 1 ou Piezo 2 em sistemas heterólogos produz correntes mecanossensitivas, sendo a cinética de inativação da corrente Piezo 2 mais rápida do que Piezo 1. Semelhante às correntes mecanossensíveis endógenas, as correntes dependentes de piezo têm potenciais de reversão em torno de 0 mV e não são seletivas, com Na +, K +, Ca2 + e Mg2 +, todos permeando o canal subjacente. Da mesma forma, as correntes piezo-dependentes são reguladas pelo potencial de membrana, com uma acentuada desaceleração da cinética da corrente em potenciais despolarizados. 86
As proteínas piezoativas são, sem dúvida, proteínas mecanossensoras e compartilham muitas propriedades de correntes mecanossensitivas de adaptação rápida em neurônios sensoriais. O tratamento de neurônios DRG cultivados com RNA de interferência curta Piezo 2 diminuiu a proporção de neurônios com corrente de rápida adaptação e diminuiu a porcentagem de neurônios mecanossensíveis.86 Os domínios transmembranares estão localizados em todas as proteínas piezoelétricas, mas não há motivos óbvios contendo poros ou assinaturas de canais iônicos identificado. No entanto, proteína Piezo 1 de camundongo purificada e reconstituída em bicamadas lipídicas assimétricas e lipossomas forma canais iônicos sensíveis ao rutênio vermelho.87 Uma etapa essencial na validação da mecanotransdução através de canais piezo é usar abordagens in vivo para determinar a importância funcional na sinalização por toque. A informação foi dada em Drosophila, onde a deleção do único membro Piezo reduziu a resposta mecânica a estímulos nocivos, sem afetar o toque normal.89 Embora sua estrutura ainda esteja por ser determinada, esta nova família de proteínas mecanossensíveis é um assunto promissor para futuras pesquisas, além da fronteira. de sensação de toque. Por exemplo, um estudo recente em pacientes com anemia (xerocitose hereditária) mostra o papel do Piezo 1 na manutenção da homeostase volumétrica dos eritrócitos.90
Transmembrana como canal (TMC)
Um estudo recente indica que duas proteínas, TMC1 e TMC2, são necessárias para a mecanotransdução de células ciliadas.91 A surdez hereditária devido à mutação do gene TMC1 foi relatada em humanos e camundongos.92,93 Presença desses canais ainda não havia sido demonstrada no sistema somatossensorial, mas parece ser uma boa pista para investigar.
Proteína semelhante a estomatina 3 (SLP3)
Além dos canais de transdução, algumas proteínas acessórias ligadas ao canal demonstraram ter um papel na sensibilidade ao toque. O SLP3 é expresso em neurônios DRG de mamíferos. Estudos utilizando ratos mutantes sem SLP3 mostraram alterações nas correntes mecanossensoras e mecanossensivas. A função precisa do 94,95 SLP3 permanece desconhecida. Pode ser um linker entre o canal mecanossensível e os microtúbulos subjacentes, como proposto por seu homólogo C. elegans MEC2.96 Recentemente GR. Lewin Lab sugeriu que uma corda é sintetizada por neurônios sensoriais DRG e liga o canal iônico mecanossensitivo à matriz extracelular.97 A interrupção da ligação elimina a corrente mecanossensitiva da RA, sugerindo que alguns canais iônicos são mecanossensíveis somente quando conectados. Correntes mecanossensitivas de RA também são inibidas pela laminina-332, uma proteína matriz produzida por queratinócitos, reforçando a hipótese de uma modulação da corrente mecanossensitiva por proteínas extracelulares.98
Subfamília de Canal K +
Paralelamente às correntes mecanossensitivas despolarizantes catiônicas, a presença de correntes K + mecanossensíveis para repolarização está sob investigação. Os canais de K + em células mecanossensíveis podem entrar em equilíbrio e contribuir para definir o limiar mecânico e o tempo de adaptação dos mecanorreceptores.
Os membros da KCNK pertencem à família dos canais K + do domínio de dois poros (K2P) .99,100 Os K2P apresentam uma notável gama de regulação por agentes celulares, físicos e farmacológicos, incluindo alterações de pH, calor, estiramento e deformação da membrana. Estes K2P estão ativos no potencial de membrana em repouso. Várias subunidades KCNK são expressas em neurônios somatossensoriais. Os canais 101 KCNK2 (TREK-1), KCNK4 (TRAAK) e TREK-2 estão entre os poucos canais para os quais foi demonstrada uma ativação mecânica direta por estiramento da membrana.102,103
Camundongos com um gene KCNK2 interrompido exibiram uma sensibilidade aumentada ao calor e estímulos mecânicos leves, mas um limiar de retirada normal para pressão mecânica nociva aplicada à pata traseira usando o teste Randall Selitto.104 Camundongos deficientes em KCNK2 também apresentam aumento da hiperalgesia térmica e mecânica em casos inflamatórios condições. Os camundongos knockout KCNK4 eram hipersensíveis à estimulação mecânica leve, e essa hipersensibilidade foi aumentada pela inativação adicional de KCNK2.105 O aumento da mecanossensibilidade desses camundongos knockout pode significar que o estiramento normalmente ativa correntes despolarizantes e repolarizantes mecanossensíveis de uma forma coordenada, semelhante ao desequilíbrio de despolarizando e repolarizando correntes dependentes de voltagem.
KCNK18 (TRESK) é um dos principais contribuintes para a condutância de K + de fundo que regula o potencial de membrana em repouso dos neurônios somatossensoriais. 106 Embora não se saiba se KCNK18 é diretamente sensível à estimulação mecânica, pode desempenhar um papel na mediação das respostas ao toque leve, bem como estímulos mecânicos dolorosos. KCNK18 e, em menor extensão, KCNK3, são propostos como o alvo molecular do hidroxi -? - sanshool, um composto encontrado nos grãos de pimenta Schezuan que ativa os receptores de toque e induz uma sensação de formigamento em humanos.
O canal K + dependente de voltagem KCNQ4 (Kv7.4) é crucial para definir a preferência de velocidade e frequência de uma subpopulação de mecanorreceptores de adaptação rápida em ambos os ratos e humanos. A mutação do KCNQ4 foi inicialmente associada a uma forma de surdez hereditária. Curiosamente, um estudo recente localiza o KCNQ4 nas terminações nervosas periféricas do folículo piloso cutâneo de rápida adaptação e do corpúsculo de Meissner. Consequentemente, a perda da função KCNQ4 leva a um aumento seletivo da sensibilidade do mecanorreceptor à vibração de baixa frequência. Notavelmente, pessoas com perda auditiva de início tardio devido a mutações dominantes do gene KCNQ4 mostram um desempenho aprimorado na detecção de vibrações de baixa amplitude e baixa frequência.109

Insight do Dr. Alex Jimenez
O toque é considerado um dos sentidos mais complexos do corpo humano, particularmente porque não há um órgão específico responsável por ele. Em vez disso, o sentido do tato ocorre através de receptores sensoriais, conhecidos como mecanorreceptores, que são encontrados através da pele e respondem à pressão mecânica ou distorção. Existem quatro tipos principais de mecanorreceptores na pele glabra ou sem pêlo de mamíferos: corpúsculos lamelares, corpúsculos táteis, terminações nervosas de Merkel e corpúsculos bulbosos. Os mecanorreceptores funcionam para permitir a detecção do tato, a fim de monitorar a posição dos músculos, ossos e articulações, conhecida como propriocepção, e até mesmo detectar sons e o movimento do corpo. A compreensão dos mecanismos de estrutura e função desses mecanorreceptores é um elemento fundamental na utilização de tratamentos e terapias para o manejo da dor.
Conclusão
O toque é um sentido complexo porque representa diferentes qualidades tácteis, nomeadamente, vibração, forma, textura, prazer e dor, com diferentes desempenhos discriminativos. Até agora, a correspondência entre um órgão de toque e o sentido psicofísico era correlativa e marcadores moleculares específicos de classe estão emergindo. O desenvolvimento de testes de roedores que correspondam à diversidade do comportamento ao toque agora é necessário para facilitar a identificação futura de genômica. O uso de camundongos que não possuem subconjuntos específicos de tipos aferentes sensoriais facilitará muito a identificação de mecanorreceptores e fibras aferentes sensoriais associados a uma modalidade de toque específica. Curiosamente, um artigo recente abre a importante questão da base genética de características mecanossensoriais em seres humanos e sugere que a mutação de gene único poderia influenciar negativamente a sensibilidade ao toque.110 Isso sublinha que a fisiopatologia do déficit do toque humano é em grande parte desconhecida e certamente progresso, identificando precisamente o subconjunto de neurônios sensoriais ligados a uma modalidade de toque ou a um déficit de toque.
Em troca, foram feitos progressos para definir as propriedades biofísicas das correntes mecanizadas. 64 O desenvolvimento de novas técnicas nos últimos anos, permitindo o monitoramento de mudanças na tensão da membrana, enquanto registra a corrente mecanizada, provou ser um método experimental valioso para descrever Correntes mecanossensitivas de adaptação rápida, intermediária e lenta (revisadas em Delmas e colaboradores) .66,111 O futuro será determinar o papel das propriedades atuais nos mecanismos de adaptação de mecanorreceptores funcionalmente diversos e a contribuição de correntes de K + mecanossensíveis para a excitabilidade de LTMRs e HTMRs.
A natureza molecular das correntes mecanizadas em mamíferos é também um futuro tópico de pesquisa promissor. Pesquisas futuras progredirão em duas perspectivas, primeiro para determinar o papel da molécula acessória que liga os canais ao citoesqueleto e que seria obrigada a conferir ou regular mecanosensibilidade dos canais iônicos das famílias TRP e ASIC / EnaC. Segundo, investigar a área grande e promissora da contribuição dos canais Piezo, respondendo a questões-chave, relativas aos mecanismos de permeação e gating, o subconjunto de neurônios sensoriais e modalidades de toque envolvendo Piezo e o papel de Piezo em células não neuronais associadas a mecanossensibilização.
O tato, em comparação com a visão, o paladar, o som e o olfato, que utilizam órgãos específicos para processar essas sensações, pode ocorrer em todo o corpo por meio de minúsculos receptores conhecidos como mecanorreceptores. Diferentes tipos de mecanorreceptores podem ser encontrados em várias camadas da pele, onde podem detectar uma ampla gama de estimulação mecânica. O artigo acima descreve destaques específicos que demonstram o progresso dos mecanismos estruturais e funcionais dos mecanorreceptores associados ao sentido do tato. Informações referenciadas do National Center for Biotechnology Information (NCBI). O escopo de nossas informações é limitado à quiropraxia, bem como a lesões e condições da coluna vertebral. Para discutir o assunto, sinta-se à vontade para perguntar ao Dr. Jimenez ou entre em contato conosco em 915-850-0900 .
Curated pelo Dr. Alex Jimenez
Tópicos adicionais: Dor nas costas
Dor nas costas é uma das causas mais comuns de incapacidade e dias perdidos no trabalho em todo o mundo. De fato, a dor nas costas tem sido atribuída como a segunda razão mais comum para visitas a consultórios, superada apenas por infecções respiratórias superiores. Aproximadamente 80 por cento da população experimentará algum tipo de dor nas costas pelo menos uma vez ao longo da vida. A coluna é uma estrutura complexa composta de ossos, articulações, ligamentos e músculos, entre outros tecidos moles. Por causa disso, lesões e / ou condições agravadas, como hérnia de discos, pode eventualmente levar a sintomas de dor nas costas. Lesões esportivas ou acidentes automobilísticos geralmente são a causa mais frequente de dor nas costas, no entanto, às vezes, o mais simples dos movimentos pode ter resultados dolorosos. Felizmente, opções alternativas de tratamento, como quiropraxia, podem ajudar a aliviar a dor nas costas através do uso de ajustes espinhais e manipulações manuais, melhorando o alívio da dor.

TÓPICO EXTRA IMPORTANTE: Low Low Pain Management
MAIS TÓPICOS: EXTRA EXTRA: Dores e tratamentos crônicos
Blank
Referências
Acordeão próximo
Escopo de prática profissional *
As informações aqui contidas em "Mecanismos Estruturais e Funcionais dos Mecanorreceptores" não se destina a substituir um relacionamento individual com um profissional de saúde qualificado ou médico licenciado e não é um conselho médico. Incentivamos você a tomar decisões de saúde com base em sua pesquisa e parceria com um profissional de saúde qualificado.
Informações do blog e discussões de escopo
Nosso escopo de informações limita-se à Quiropraxia, musculoesquelética, medicamentos físicos, bem-estar, contribuindo distúrbios viscerossomáticos dentro de apresentações clínicas, dinâmica clínica de reflexo somatovisceral associada, complexos de subluxação, questões de saúde sensíveis e/ou artigos, tópicos e discussões de medicina funcional.
Nós fornecemos e apresentamos colaboração clínica com especialistas de várias disciplinas. Cada especialista é regido por seu escopo profissional de prática e sua jurisdição de licenciamento. Usamos protocolos funcionais de saúde e bem-estar para tratar e apoiar o cuidado de lesões ou distúrbios do sistema músculo-esquelético.
Nossos vídeos, postagens, tópicos, assuntos e insights abrangem assuntos clínicos, problemas e tópicos relacionados e apoiam direta ou indiretamente nosso escopo de prática clínica.*
Nosso escritório tentou razoavelmente fornecer citações de apoio e identificou o estudo de pesquisa relevante ou estudos que apóiam nossas postagens. Fornecemos cópias dos estudos de pesquisa de apoio à disposição dos conselhos regulatórios e do público mediante solicitação.
Entendemos que cobrimos questões que requerem uma explicação adicional de como isso pode ajudar em um plano de cuidados ou protocolo de tratamento específico; portanto, para discutir melhor o assunto acima, sinta-se à vontade para perguntar Dr. Alex Jiménez, DC, ou contacte-nos 915-850-0900.
Estamos aqui para ajudar você e sua família.
Bênçãos
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
o email: coach@elpasofunctionalmedicine. com
Licenciado como Doutor em Quiropraxia (DC) em Texas & Novo México*
Licença DC do Texas # TX5807, Novo México DC Licença # NM-DC2182
Licenciada como enfermeira registrada (RN*) in Florida
Licença da Flórida Licença RN # RN9617241 (Controle nº 3558029)
Status compacto: Licença Multiestadual: Autorizado para exercer em Estados 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Meu cartão de visita digital







