Chiropractor baseado na ciência Dr. Alexander Jimenez olha para estresse oxidativo, o que é, como isso afeta o corpo e a defesa antioxidante para remediar a situação.
Esra Birben PhD, 1 Umit Murat Sahiner MD, 1 Cansin Sackesen MD, 1 Serpil Erzurum MD, 2 e Omer Kalayci, MD1
Resumo: As espécies reativas de oxigênio (ROS) são produzidas por organismos vivos como resultado do metabolismo celular normal e de fatores ambientais, como poluentes do ar ou fumaça de cigarro. ROS são moléculas altamente reativas e podem danificar estruturas celulares como carboidratos, ácidos nucléicos, lipídios e proteínas e alterar suas funções. A mudança no equilíbrio entre oxidantes e antioxidantes em favor dos oxidantes é denominada “estresse oxidativo”. A regulação do estado de redução e oxidação (redox) é crítica para a viabilidade celular, ativação, proliferação e função do órgão. Os organismos aeróbicos têm sistemas antioxidantes integrados, que incluem antioxidantes enzimáticos e não enzimáticos que geralmente são eficazes no bloqueio dos efeitos prejudiciais das ROS. No entanto, em condições patológicas, os sistemas antioxidantes podem ser sobrecarregados. O estresse oxidativo contribui para muitas condições e doenças patológicas, incluindo câncer, distúrbios neurológicos, aterosclerose, hipertensão, isquemia / perfusão, diabetes, síndrome do desconforto respiratório agudo, fibrose pulmonar idiopática, doença pulmonar obstrutiva crônica e asma. Nesta revisão, resumimos os sistemas oxidante e antioxidante celular e discutimos os efeitos e mecanismos celulares do estresse oxidativo.
Palavras-chave: antioxidante, oxidante, estresse oxidativo, espécies reativas de oxigênio, redox
(WAO Journal 2012; 5: 9 19)
As espécies reativas de oxigênio (ROS) são produzidas por organismos vivos como resultado do metabolismo celular normal. Em concentrações baixas a moderadas, eles funcionam em processos celulares fisiológicos, mas em altas concentrações, eles produzem modificações adversas nos componentes celulares, como lipídios, proteínas e DNA.1 6 A mudança no equilíbrio entre oxidante / antioxidante em favor de oxidantes é denominado estresse oxidativo. O estresse oxidativo contribui para muitas condições patológicas, incluindo câncer, distúrbios neurológicos, 7 10 aterosclerose, hipertensão, isquemia / perfusão, 11 14 diabetes, síndrome do desconforto respiratório agudo, fibrose pulmonar idiopática, doença pulmonar obstrutiva crônica , 15 e asma.16 21 Os organismos aeróbicos têm sistemas antioxidantes integrados, que incluem antioxidantes enzimáticos e não enzimáticos que geralmente são eficazes no bloqueio dos efeitos prejudiciais das ROS. No entanto, em condições patológicas, os sistemas antioxidantes podem ser sobrecarregados. Nesta revisão, resumimos os sistemas oxidantes e antioxidantes celulares e a regulação do estado de redução e oxidação (redox) em estados de saúde e doença.
Conteúdo
OXIDANTES
Fontes Endógenas de ROS
Os ROS são produzidos a partir de oxigênio molecular como resultado do metabolismo celular normal. Os ROS podem ser divididos em grupos 2: radicais livres e não-radicais. As moléculas que contêm um ou mais elétrons não emparedados e, portanto, proporcionam reatividade à molécula são chamadas de radicais livres. Quando os radicais livres 2 compartilham seus elétrons não pareados, as formas não-radicais são criadas. Os ROS principais de 3 que são de significância fisiológica são o anião superóxido (O22.), O radical hidroxilo (OH) e o peróxido de hidrogênio (H2O2). Os ROS estão resumidos na Tabela 1.
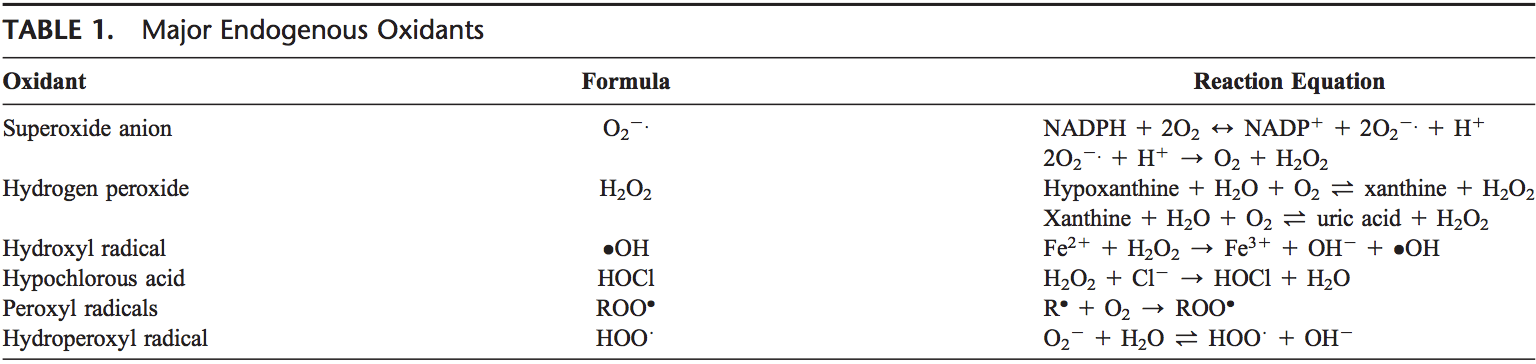
O ânion superóxido é formado pela adição de 1 elétron ao oxigênio molecular.22 Esse processo é mediado pela nicotina adenina dinucleotídeo fosfato [NAD (P) H] oxidase ou xantina oxidase ou pelo sistema de transporte de elétrons mitocondrial. O principal local para a produção de ânion superóxido é a mitocôndria, a maquinaria da célula para produzir trifosfato de adenosina. Normalmente, os elétrons são transferidos através da cadeia de transporte de elétrons mitocondrial para a redução do oxigênio em água, mas aproximadamente 1 a 3% de todos os elétrons vazam do sistema e produzem superóxido. A NAD (P) H oxidase é encontrada em leucócitos polimorfonucleares, monócitos e macrófagos. Após a fagocitose, essas células produzem uma explosão de superóxido que leva à atividade bactericida. O superóxido é convertido em peróxido de hidrogênio pela ação das superóxido dismutases (SODs, EC 1.15.1.1). O peróxido de hidrogênio se difunde facilmente pela membrana plasmática. O peróxido de hidrogênio também é produzido pela xantina oxidase, aminoácido oxidase e NAD (P) H oxidase 23,24 e em peroxissomos pelo consumo de oxigênio molecular em reações metabólicas. Em uma sucessão de reações chamadas reações de Haber Weiss e Fenton, H2O2 pode se decompor em OH2 na presença de metais de transmissão como Fe21 ou Cu21.25
Fe31 + .O2 ? Fe2 + O2 Haber Weiss
Fe2 + H2O2 ? Fe3 + OH + .OH Reação de Fenton
O próprio O 2 também pode reagir com H2 O2 e gerar OH .26,27 O radical hidroxila é o mais reativo das ROS e pode danificar proteínas, lipídios, carboidratos e DNA. Ele também pode iniciar a peroxidação lipídica ao retirar um elétron dos ácidos graxos poliinsaturados.
As enzimas granulocíticas expandem ainda mais a reatividade de H2O2 via peroxidase de eosinófilos e mieloperoxidase (MPO). Em neutrófilos ativados, H2O2 é consumido por MPO. Na presença de íon cloreto, H2O2 é convertido em ácido hipocloroso (HOCl). O HOCl é altamente oxidativo e desempenha um papel importante na morte dos patógenos nas vias aéreas.28 No entanto, o HOCl também pode reagir com o DNA e induzir interações da proteína DNA e produzir produtos de oxidação da pirimidina e adicionar cloreto às bases do DNA.29,30 Peroxidase de eosinófilos e a MPO também contribuem para o estresse oxidativo por modificação de proteínas por halogenações, nitração e ligações cruzadas de proteínas por meio de radicais tirosil.31 33
Outros radicais livres derivados de oxigênio são os radicais peroxil (ROO $). A forma mais simples destes radicais é o radical hidroperxílico (HOO $) e tem papel na peroxidação de ácidos gordos. Os radicais livres podem desencadear reações em cadeia da peroxidação lipídica, abstraindo um átomo de hidrogênio de um carbono de metileno de cadeia lateral. O radical lipídico então reage com oxigênio para produzir radical peroxilo. O radical peroxilo inicia uma reação em cadeia e transforma os ácidos gordurosos poliinsaturados em hidroperóxidos lipídicos. Os hidroperóxidos lipídicos são muito instáveis e facilmente decompostos em produtos secundários, como aldeídos (como 4-hidroxi-2,3-não-real) e malondialdeídos (MDAs). Os isoprostanos são outro grupo de produtos de peroxidação lipídica que são gerados através da peroxidação do ácido araquidônico e também foram encontrados em níveis elevados de plasma e condensados respiratórios de asmáticos. 34,35 A peroxidação de lipídios perturba a integridade das membranas celulares e leva ao rearranjo da estrutura da membrana .
O peróxido de hidrogênio, o radical superóxido, a glutationa oxidada (GSSG), MDAs, isoprostanos, carbonilos e nitrotirosina podem ser facilmente medidos a partir de amostras de lavagem de plasma, sangue ou broncoalveolar como biomarcadores de oxidação por ensaios padronizados.
Fonte Exógena de Oxidantes
Fumaça de cigarro
A fumaça de cigarro contém muitos oxidantes e radicais livres e compostos orgânicos, como superóxido e óxido nítrico. 36 Além disso, a inalação da fumaça do cigarro no pulmão também ativa alguns mecanismos endógenos, como o acúmulo de neutrófilos e macrófagos, o que aumenta ainda mais a lesão oxidante .
Exposição ao ozônio
A exposição ao ozônio pode causar peroxidação lipídica e induzir influxo de neutrófilos no epitélio das vias aéreas. A exposição a curto prazo ao ozônio também causa a liberação de mediadores inflamatórios, como MPO, proteínas catiônicas de eosinófilos e também lactato desidrogenase e albumina. 37 Mesmo em indivíduos saudáveis, a exposição ao ozônio causa uma redução nas funções pulmonares. 38 Cho et al39 demonstraram que matéria particulada (mistura de partículas sólidas e gotículas líquidas suspensas no ar) catalisa a redução de oxigênio.
Hiperoxia
Hiperoxia refere-se a condições de níveis mais elevados de oxigênio do que a pressão parcial normal de oxigênio nos pulmões ou outros tecidos corporais. Isso leva a uma maior produção de espécies reativas de oxigênio e nitrogênio. 40,41
Radiação ionizante
A radiação ionizante, na presença de O2, converte o radical hidroxila, superóxido e radicais orgânicos em peróxido de hidrogênio e hidroperóxidos orgânicos. Essas espécies de hidroperóxidos reagem com íons metálicos redox ativos, como Fe e Cu, por meio de reações de Fenton e, assim, induzem estresse oxidativo.42,43 Narayanan e cols.44 mostraram que fibroblastos que foram expostos a partículas alfa tiveram aumentos significativos em O2 2 intracelular e H2O2 produção via NADPH oxidase ligada à membrana plasmática.44 Moléculas de transdução de sinal, como quinase 1 e 2 regulada por sinal extracelular (ERK1 / 2), quinase N-terminal c-Jun (JNK) e p38, e fatores de transcrição, como proteína ativadora-1 (AP-1), fator nuclear-kB (NF-kB) e p53, são ativados, o que resulta na expressão de genes relacionados à resposta à radiação.45 50 fótons ultravioleta A (UVA) desencadeiam reações oxidativas por excitação de fotossensibilizadores endógenos, como porfirinas, NADPH oxidase e riboflavinas. 8-Oxo-7,8-dihidroguanina (8-oxoGua) é o principal produto de oxidação do DNA mediado por UVA formado pela oxidação do radical OH, oxidantes de 1 elétron e oxigênio singlete que reage principalmente com a guanina.51 A formação de guanina Foi demonstrado que o cátion radical no DNA isolado ocorre de forma eficiente por meio do efeito direto da radiação ionizante.52,53 Após a exposição à radiação ionizante, o nível intracelular de glutationa (GSH) diminui por um curto prazo, mas depois aumenta novamente.54
Ions de metais pesados
Os íons de metais pesados, como ferro, cobre, cádmio, mercúrio, níquel, chumbo e arsênico, podem induzir a geração de radicais reativos e causar danos celulares através da depleção de atividades enzimáticas através da peroxidação lipídica e reação com proteínas nucleares e DNA.55
Um dos mecanismos mais importantes de geração de radicais livres mediada por metal é por meio de uma reação do tipo Fenton. O íon superóxido e o peróxido de hidrogênio podem interagir com metais de transição, como ferro e cobre, por meio da reação de Haber Weiss / Fenton catalisada por metal para formar radicais OH.
Metal31 1 $ O2 / Metal21 1 O2 Haber Weiss Metal21 1 H2 O2 / Metal31 1 OH 2 1 $ OH Reação de Fenton
Além dos mecanismos do tipo Fenton e do tipo Haber Weiss, certos íons metálicos podem reagir diretamente com moléculas celulares para gerar radicais livres, como os radicais tiol, ou induzir vias de sinalização celular. Esses radicais também podem reagir com outras moléculas de tiol para gerar O22 .. O22. é convertido em H2O2, o que causa a geração adicional de radicais de oxigênio. Alguns metais, como o arsenito, induzem a formação de ROS indiretamente pela ativação de sistemas produtores de radicais nas células.56
O arsênio é um elemento altamente tóxico que produz uma variedade de ROS, incluindo superóxido (O2 2), oxigênio singlete (1O2), radical peroxil (ROO), óxido nítrico (NO), peróxido de hidrogênio (H2O2) e radicais peroxil dimetilarsínico [( CH3) 2AsOO] .57 59 Os compostos de arsênio (III) podem inibir enzimas antioxidantes, especialmente as enzimas dependentes de GSH, como glutationa-S-transferases (GSTs), glutationa peroxidase (GSH-Px) e GSH redutase, via ligação - em seus grupos sulfidrila ( SH ).60,61
O chumbo aumenta a peroxidação lipídica. 62 As diminuições significativas na atividade de SOD de tecido e GPx cerebral foram relatadas após a exposição ao chumbo.63,64 A substituição de zinco, que serve como cofator para muitas enzimas por chumbo, leva à inativação de tais enzimas. A exposição ao chumbo pode causar inibição da GST ao afetar os teolos de tecidos.
Os ROS gerados por reações catalisadas por metal podem modificar as bases de DNA. Três substituições de base, G / C, G / T e C / T podem ocorrer como resultado do dano oxidativo por íons metálicos, como Fe21, Cu21 e Ni21. Reid et al65 mostraram que G / C foi produzido predominantemente por Fe21 enquanto a substituição de C / T era por Cu21 e Ni21.
ANTIOXIDANTES
O corpo humano está equipado com uma variedade de antioxidantes que servem para contrabalançar o efeito dos oxidantes. Para todos os efeitos práticos, estes podem ser divididos em categorias 2: enzimática (Tabela 2) e não enzimática (Tabela 3).
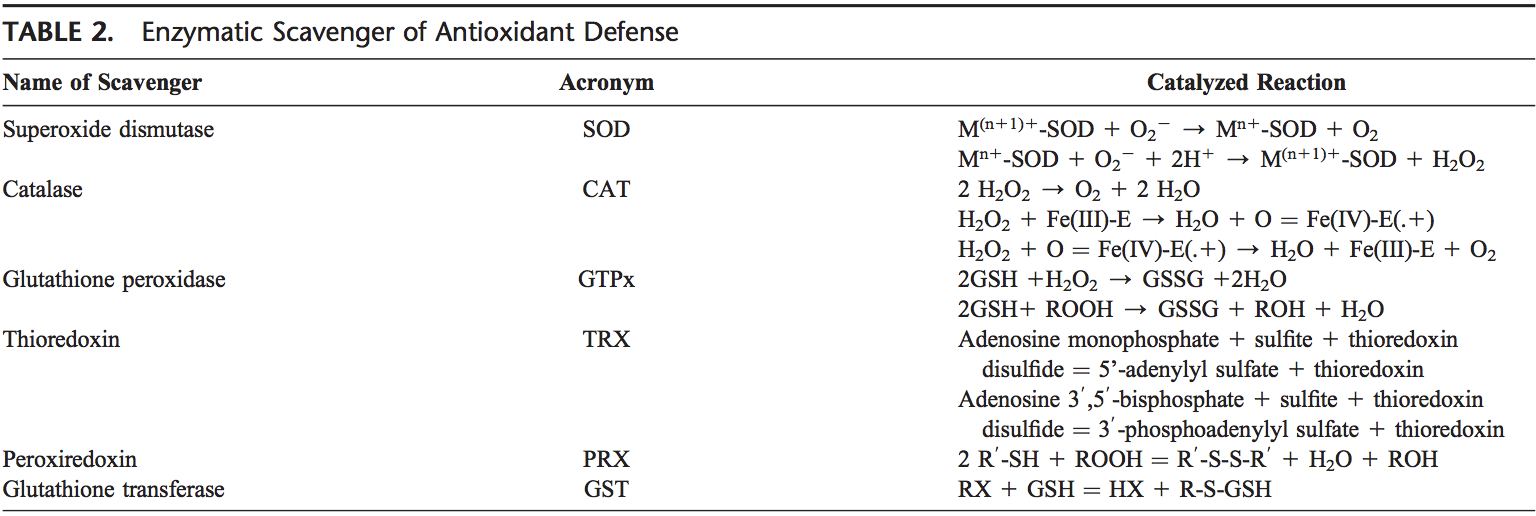
Antioxidantes enzimáticos
Os principais antioxidantes enzimáticos dos pulmões são SODs (EC 1.15.1.11), catalase (EC 1.11.1.6) e GSH-Px (EC 1.11.1.9). Além dessas enzimas principais, outros antioxidantes, incluindo heme oxigenase-1 (EC 1.14.99.3) e proteínas redox, tais como tioredoxinas (TRXs, EC 1.8.4.10), peroxiredoxinas (PRXs, EC 1.11.1.15) e glutaredoxinas, também foram encontrados para desempenham papéis cruciais nas defesas antioxidantes pulmonares.
Uma vez que o superóxido é o ROS primário produzido a partir de uma variedade de fontes, a sua dismutação pelo SOD é de primordial importância para cada célula. Todas as formas 3 de SOD, isto é, CuZn-SOD, Mn-SOD e EC-SOD, são amplamente expressas no pulmão humano. O Mn-SOD está localizado na matriz mitocondria. O EC-SOD é principalmente localizado na matriz extracelular, especialmente em áreas contendo altas quantidades de fibras de colágeno tipo I e em torno de vasos pulmonares e sistêmicos. Também foi detectado no epitélio brônquico, no epitélio alveolar e nos macrófagos alveolares. 66,67 Em geral, CuZn-SOD e Mn-SOD são geralmente pensados para atuar como eliminadores a granel de radicais superóxido. O nível de CE-SOD relativamente elevado no pulmão com a sua ligação específica aos componentes da matriz extracelular pode representar um componente fundamental da proteção da matriz pulmonar. 68
H2O2 que é produzido pela ação de SODs ou a ação de oxidases, como xantina oxidase, é reduzida a água por catalase e GSH-Px. A catalase existe como um tetramer composto por monómeros 4 idênticos, cada um dos quais contém um grupo heme no local ativo. A degradação de H2O2 é realizada através da conversão entre conformações 2 de catalase-ferricatalase (ferro coordenado com água) e composto I (ferro complexado com um átomo de oxigênio). A catalase também se liga ao NADPH como um equivalente de redução para prevenir a inativação oxidativa da enzima (formação do composto II) por H2O2, pois é reduzida à água. 69
Enzimas no ciclo redox responsável pela redução de H2O2 e hidroperóxidos lipídicos (gerados como resultado da peroxidação lipídica da membrana) incluem o GSH-Pxs.70. Os GSH-Pxs são uma família de enzimas tetraméricas que contêm a única selenocisteína de aminoácidos dentro da sites ativos e usam tióis de baixo peso molecular, como GSH, para reduzir H2O2 e peróxidos lipídicos aos seus álcoois correspondentes. Foram descritos quatro GSH-Pxs, codificados por diferentes genes: GSH-Px-1 (GSH-Px celular) é onipresente e reduz H2O2 e peróxidos de ácidos gordos, mas não lipídios de peroxilo esterificados. 71 Os lípidos esterificados são reduzidos por GSH ligado à membrana -Px-4 (hidroperóxido de fosfolípido GSH-Px), que pode usar vários diferentes tióis de baixo peso molecular como equivalentes de redução. GSH-Px-2 (GSH-Px gastrointestinal) está localizado em células epiteliais gastrointestinais, onde serve para reduzir peróxidos alimentares. 72 GSH-Px-3 (GSH-Px extracelular) é o único membro da família GSH-Px que reside em o compartimento extracelular e acredita-se que seja uma das enzimas antioxidantes extracelulares mais importantes em mamíferos. Destes, o GSH-Px extracelular é mais amplamente investigado no pulmão humano. 73
Além disso, a eliminação de H2O2 está estreitamente associada a várias enzimas contendo tiol, nomeadamente TRXs (TRX1 e TRX2), tioredoxina reductasas (EC 1.8.1.9) (TRRs), PRXs (que são as peroxidases de tiorrecoxina) e glutaredoxins.74
Dois TRXs e TRRs foram caracterizados em células humanas, existentes tanto no citosol como nas mitocôndrias. No pulmão, TRX e TRR são expressos no epitélio e nos macrófagos brônquicos e alveolares. Seis PRX diferentes foram encontrados em células humanas, diferindo em sua compartimentação ultra-estrutural. Estudos experimentais revelaram a importância do PRX VI na proteção do epitélio alveolar. O pulmão humano expressa todos os PRXs no epitélio brônquico, epitélio alveolar e macrófagos. 75 PRX V recentemente foi encontrado para funcionar como uma redutase de peroxinitrito, 76, o que significa que pode funcionar como um composto potencial de proteção no desenvolvimento de lesões pulmonares mediadas por ROS .77
Comum a estes antioxidantes é o requisito de NADPH como um equivalente de redução. NADPH mantém a catalase na forma ativa e é usado como cofator por TRX e GSH redutase (EC 1.6.4.2), que converte GSSG em GSH, um co-substrato para GSH-Pxs. O NADPH intracelular, por sua vez, é gerado pela redução de NADP1 por glicose-6-fosfato desidrogenase, a primeira e enzima limitante de taxa de penetração de fosfato, durante a conversão de glicose-6-fosfato em 6-fosfogluconolactona. Ao gerar NADPH, a glicose-6-fosfato desidrogenase é um determinante crítico da capacidade de tampão GSH citosólica (GSH / GSSG) e, portanto, pode ser considerada uma enzima antioxidante reguladora e essencial. 78,79
GSTs (EC 2.5.1.18), outra família de enzimas antioxidantes, inativa metabólitos secundários, como aldeídos insaturados, epóxidos e hidroperóxidos. Três famílias principais de GSTs foram descritas: GST citosólico, GST mitocondrial, 80,81 e GST microssômico associado à membrana que tem um papel no metabolismo de eicosanóides e GSH.82 Sete classes de GST citosólico são identificadas em mamíferos, designadas Alfa, Mu, Pi, Sigma, Theta, Omega e Zeta.83 86 Durante condições sem estresse, os GSTs de classe Mu e Pi interagem com as cinases Ask1 e JNK, respectivamente, e inibem essas cinases.87 89 Foi demonstrado que GSTP1 se dissocia de JNK em resposta ao estresse oxidativo.89 O GSTP1 também interage fisicamente com PRX VI e leva à recuperação da atividade da enzima PRX por meio da glutationilação da proteína oxidada.90
Antioxidantes não enzimáticos
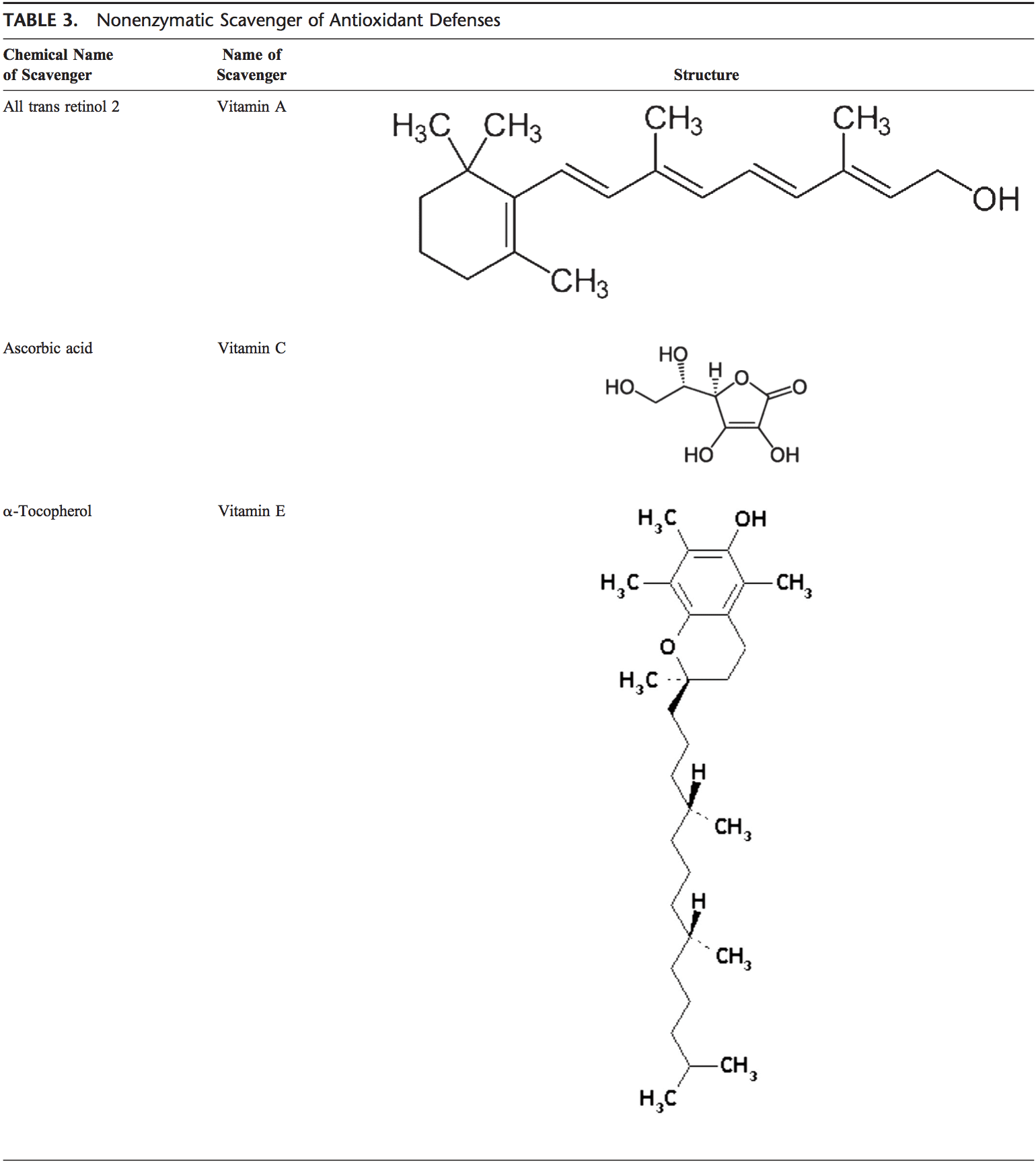
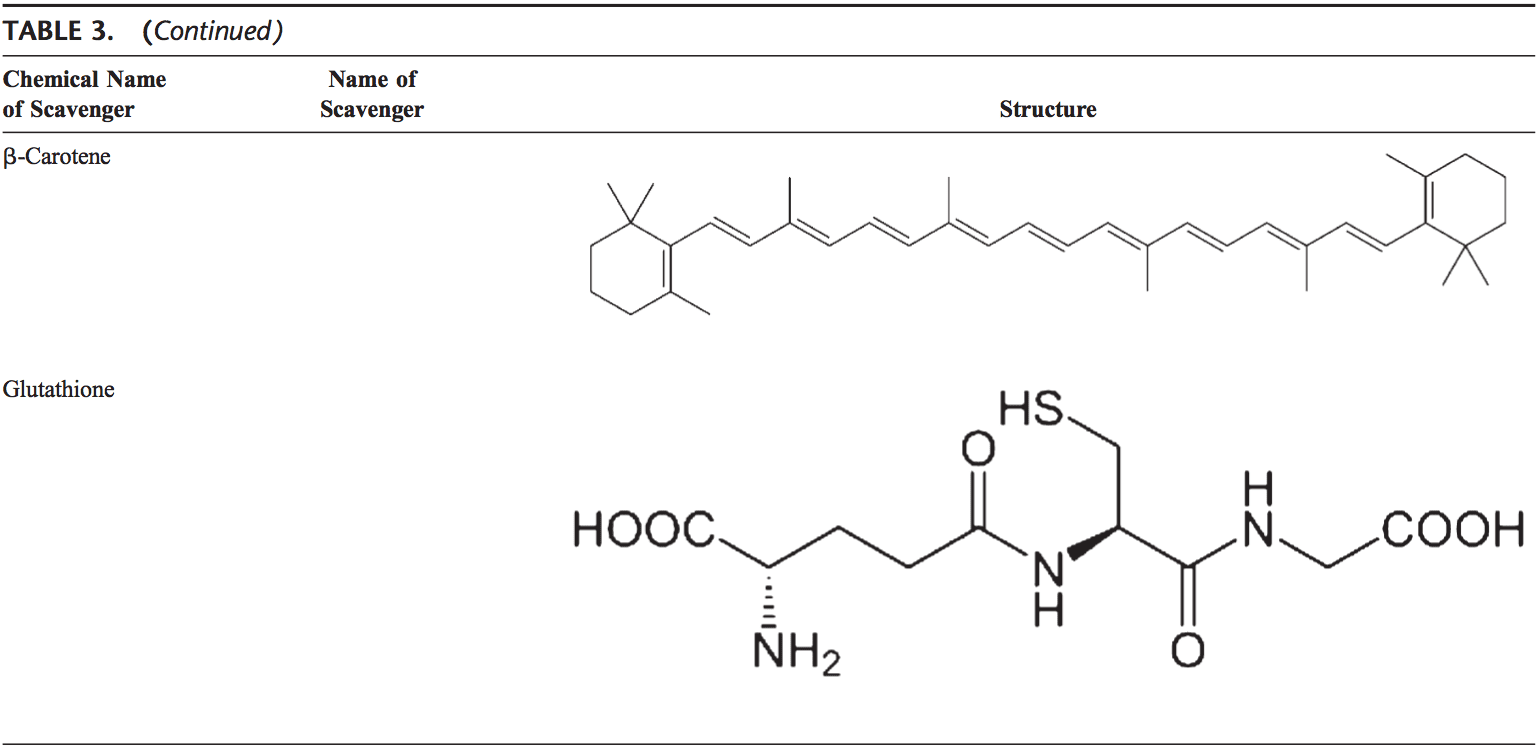
Os antioxidantes não enzimáticos incluem compostos de baixo peso molecular, como vitaminas (vitaminas C e E), b-caroteno, ácido úrico e GSH, um tripeptídeo (Lg-glutamil-L-cisteinil-L-glicina) que compreende um tiol ( sulfidrilo).
A vitamina C (ácido ascórbico)
A vitamina C solúvel em água (ácido ascórbico) fornece capacidade antioxidante de fase aquosa intracelular e extracelular principalmente por eliminação de radicais livres de oxigênio. Converte os radicais livres da vitamina E de volta à vitamina E. Seus níveis de plasma mostraram diminuir com a idade. 91,92
Vitamina E (a-tocoferol)
A vitamina E lipossolúvel é concentrada no local interior hidrofóbico da membrana celular e é a principal defesa contra a lesão da membrana induzida por oxidantes. A vitamina E doa o elétron ao radical peroxilo, que é produzido durante a peroxidação lipídica. A-Tocoferol é a forma mais ativa de vitamina E e o principal antioxidante ligado à membrana nas células. A vitamina E desencadeia a apoptose das células cancerosas e inibe as formações de radicais livres. 93
Glutationa
GSH é altamente abundante em todos os compartimentos celulares e é o principal antioxidante solúvel. A relação GSH / GSSG é um importante determinante do estresse oxidativo. GSH mostra seus efeitos antioxidantes de várias maneiras. 94 Desintoxica peróxido de hidrogênio e peróxidos lipídicos por meio da ação do GSH-Px. GSH doa seu elétron para H2O2 para reduzi-lo em H2O e O2. GSSG é novamente reduzido em GSH pela redutase GSH que usa NAD (P) H como o doador de elétrons. Os GSH-Pxs também são importantes para a proteção da membrana celular a partir da peroxidação lipídica. A glutationa reduzida doa prótons para lipídios da membrana e os protege de ataques oxidantes. 95
GSH é um cofator para várias enzimas desintoxicantes, como GSH-Px e transferase. Tem um papel na conversão de vitamina C e E de volta às suas formas ativas. O GSH protege as células contra a apoptose ao interagir com as vias de sinalização proapoptótica e antiapoptótica. 94 Também regula e ativa vários fatores de transcrição, como AP-1, NF-kB e Sp-1.
Carotenóides (b-caroteno)
Os carotenóides são pigmentos encontrados nas plantas. Principalmente, o b-caroteno encontrou-se reagir com os radicais de peroxilo (ROO), hidroxilo (OH) e superóxido (O22.). Os carotenóides 96 mostram seus efeitos antioxidantes em baixa pressão parcial de oxigênio, mas podem ter efeitos pró-oxidantes em oxigênio superior Concentrações. 97 Ambos os carotenóides e os ácidos retinóicos (RAs) são capazes de regular os fatores de transcrição. 98 b-Carotene inibe a ativação do NF-kB induzido pelo oxidante e a interleucina (IL) -6 e o fator de necrose tumoral - uma produção. Os carotenóides também afetam a apoptose das células. Os efeitos antiproliferativos da AR foram demonstrados em vários estudos. Este efeito da AR é mediado principalmente por receptores de ácido retinóico e varia entre os tipos celulares. Nas células de carcinoma mamário, o receptor de ácido retinoico mostrou que desencadeia a inibição do crescimento induzindo a prisão do ciclo celular, apoptose ou ambos. 99,100
O EFEITO DO ESTRESSE OXIDATIVO: MECANISMOS GENÉTICOS, FISIOLÓGICOS E BIOQUÍMICOS
O estresse oxidativo ocorre quando o equilíbrio entre antioxidantes e ROS são interrompidos devido à depleção de antioxidantes ou à acumulação de ROS. Quando o estresse oxidativo ocorre, as células tentam neutralizar os efeitos oxidantes e restaurar o equilíbrio redox por ativação ou silenciamento de genes que codificam enzimas defensivas, fatores de transição e proteínas estruturais. 101,102 A relação entre glutationa oxidada e reduzida (2GSH / GSSG) é uma dos determinantes importantes do estresse oxidativo no corpo. A maior produção de ROS no corpo pode alterar a estrutura do DNA, resultar na modificação de proteínas e lipídios, ativação de vários fatores de transcrição induzidos pelo estresse e produção de citocinas pró-inflamatórias e anti-inflamatórias.
Efeitos do estresse oxidativo no DNA
O ROS pode levar a modificações do DNA de várias maneiras, o que envolve degradação de bases, rupturas de ADN de cadeia simples ou dupla, purina, pirimidina ou modificações ligadas ao açúcar, mutações, deleções ou translocações e reticulação com proteínas. A maioria dessas modificações de DNA (Fig. 1) são altamente relevantes para carcinogênese, envelhecimento e doenças neurodegenerativas, cardiovasculares e auto-imunes. A fumaça do tabaco, os metais redox e os metais não redox, como ferro, cádmio, cromo e arsênico, também estão envolvidos na carcinogênese e no envelhecimento, gerando radicais livres ou ligando-se a grupos tiol. A formação de 8-OH-G é o dano de ADN mais conhecido que ocorre por meio do estresse oxidativo e é um biomarcador potencial para a carcinogênese.
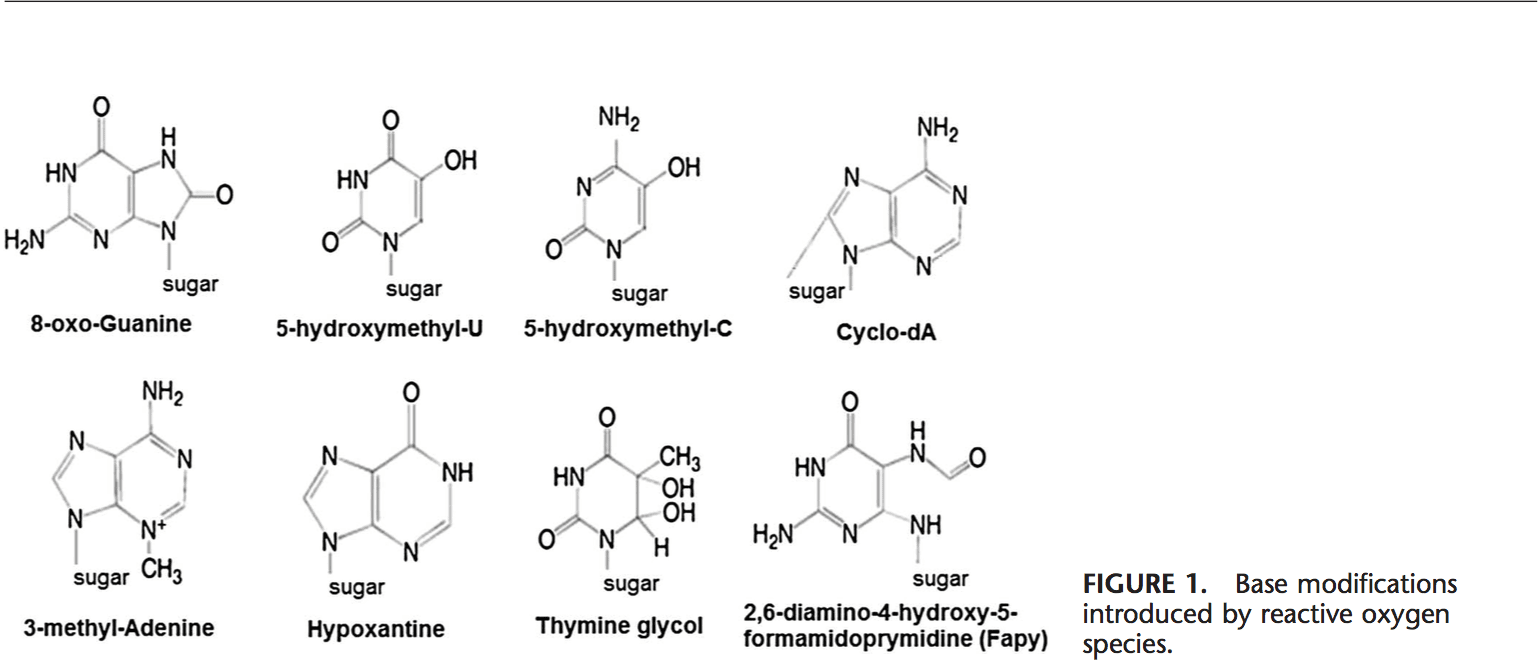
As regiões promotoras dos genes contêm sequências de consenso para fatores de transcrição. Esses sítios de ligação do fator de transcrição contêm sequências ricas em GC que são suscetíveis a ataques de oxidantes. A formação de DNA 8-OH-G em locais de ligação de fator de transcrição pode modificar a ligação de fatores de transcrição e, assim, alterar a expressão de genes relacionados, como foi demonstrado para sequências alvo AP-1 e Sp-1 Além de 103-OH-G, 8 -ciclo-8,59-desoxiadenosina (ciclo-dA) também demonstrou inibir a transcrição de um gene repórter em um sistema celular se localizado em uma caixa TATA.29 A proteína de ligação a TATA inicia a transcrição alterando a curvatura do DNA . A ligação da proteína de ligação a TATA pode ser prejudicada pela presença de ciclo-dA.
O estresse oxidativo causa instabilidade de regiões de microssatélites (repetições em tandem curtas). Os íons metálicos ativos Redox, os radicais hidroxílicos aumentam a instabilidade dos microsatérios. 105 Embora as rupturas de DNA de cadeia simples causadas por lesão oxidante possam ser facilmente toleradas pelas células, as rupturas de DNA de cadeia dupla induzidas por radiação ionizante podem ser uma ameaça significativa para a sobrevivência celular. 106
A metilação nas ilhas CpG no DNA é um importante mecanismo epigenético que pode resultar em silenciamento gênico. A oxidação de 5-MeCyt para 5-hidroximetil uracilo (5-OHMeUra) pode ocorrer através de reações de desingação / oxidação de intermediários de timina ou 5-hidroximetil citosina. 107 Além da expressão genética moduladora, a metilação do DNA também parece afetar a organização da cromatina. 108 Os padrões aberrantes de metilação do DNA induzidos por ataques oxidativos também afetam a atividade de reparo do DNA.
Efeitos do estresse oxidativo em lipídios
ROS pode induzir peroxidação lipídica e interromper o arranjo da bicamada lipídica da membrana que pode inativar receptores e enzimas ligados à membrana e aumentar a permeabilidade do tecido.109 Produtos de peroxidação lipídica, como MDA e aldeídos insaturados, são capazes de inativar muitas proteínas celulares por meio da formação de proteínas -ligações.110 112 4-Hidroxi-2-nonenal causa depleção de GSH intracelular e induz a produção de peróxido, 113,114 ativa o receptor do fator de crescimento epidérmico 115 e induz a produção de fibronectina.116 Produtos de peroxidação lipídica, como isoprostanos e substâncias reativas ao ácido tiobarbitúrico , têm sido usados como biomarcadores indiretos de estresse oxidativo, e níveis aumentados foram mostrados no condensado do ar exalado ou no fluido de lavagem broncoalveolar ou no pulmão de pacientes com doença pulmonar obstrutiva crônica ou fumantes.117 119
Efeitos do estresse oxidativo nas proteínas
ROS podem causar fragmentação da cadeia peptídica, alteração da carga elétrica de proteínas, reticulação de proteínas e oxidação de aminoácidos específicos e, portanto, levar ao aumento da suscetibilidade à proteólise por degradação por proteases específicas.120 Resíduos de cisteína e metionina nas proteínas são particularmente mais suscetível à oxidação.121 A oxidação de grupos sulfidrila ou resíduos de metionina de proteínas causa alterações conformacionais, desdobramento de proteínas e degradação.8,121 123 Enzimas que têm metais em ou perto de seus locais ativos são especialmente mais sensíveis à oxidação catalisada por metal. A modificação oxidativa de enzimas demonstrou inibir suas atividades.124,125
Em alguns casos, a oxidação específica das proteínas pode ocorrer. Por exemplo, a metionina pode ser oxidada sulfato de metionina126 e fenilalanina a o-tirosina127; Os grupos sulfidrilo podem ser oxidados para formar ligações dissulfureto; os grupos 128 e carbonilo podem ser introduzidos nas cadeias laterais das proteínas. Os raios gama, oxidação catalisada por metal, HOCl e ozônio podem causar a formação de grupos carbonilo. 129
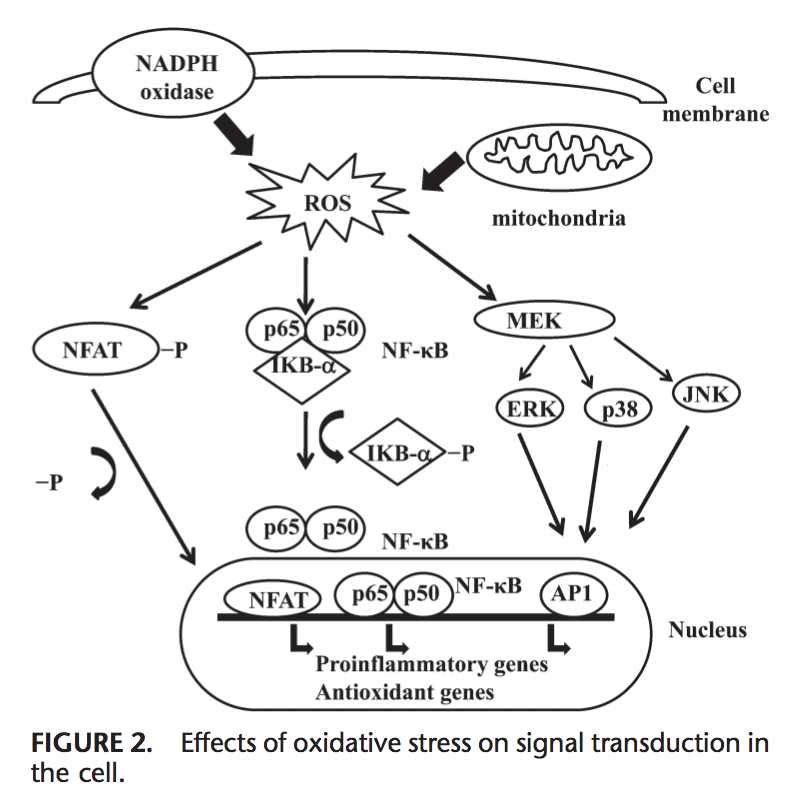
Efeitos do estresse oxidativo na transdução do sinal
ROS pode induzir a expressão de vários genes envolvidos na transdução de sinal.1,130 Uma alta proporção para GSH / GSSG é importante para a proteção da célula de danos oxidativos. A ruptura dessa proporção causa ativação de fatores de transcrição redox sensíveis, como NF-kB, AP-1, fator nuclear de células T ativadas e fator 1 indutível por hipóxia, que estão envolvidos na resposta inflamatória. A ativação de fatores de transcrição via ROS é obtida por cascatas de transdução de sinal que transmitem a informação de fora para dentro da célula. Receptores de tirosina quinase, a maioria dos receptores de fator de crescimento, como receptor de fator de crescimento epidérmico, receptor de fator de crescimento endotelial vascular e receptor de fator de crescimento derivado de plaquetas, proteína tirosina fosfatases e serina / treonina quinases são alvos de ROS.131 133 Quinases extracelulares reguladas por sinal, JNK e p38, que são os membros da família da proteína quinase ativada por mitogênio e envolvidas em vários processos celulares, incluindo proliferação, diferenciação e apoptose, também podem ser reguladas por oxidantes.
Sob condições de estresse oxidativo, os resíduos de cisteína no sítio de ligação ao DNA de c-Jun, algumas subunidades AP-1 e a quinase kB inibitória sofrem glutatiolação S reversível. Foi relatado que glutaredoxina e TRX desempenham um papel importante na regulação das vias de sinalização sensíveis a redox, como NF-kB e AP-1, proteína quinase ativada por mitogênio p38 e JNK.134 137
NF-kB pode ser ativado em resposta a condições de estresse oxidativo, como ROS, radicais livres e irradiação UV.138 A fosforilação de IkB libera NF-kB e permite que ele entre no núcleo para ativar a transcrição do gene.139 Várias quinases têm foi relatado que fosforila IkBs nos resíduos de serina. Essas quinases são os alvos dos sinais oxidativos para a ativação do NF-kB.140. Os agentes redutores aumentam a ligação do NF-kB ao DNA, enquanto os agentes oxidantes inibem a ligação do NF-kB ao DNA. TRX pode exercer 2 ações opostas na regulação de NF-kB: no citoplasma, ele bloqueia a degradação de IkB e inibe a ativação de NF-kB, mas aumenta a ligação ao DNA de NF-kB no núcleo.141 Ativação de NF-kB por meio de degradação relacionada à oxidação de IkB resulta na ativação de vários genes relacionados à defesa antioxidante. O NF-kB regula a expressão de vários genes que participam da resposta imune, como IL-1b, IL-6, fator de necrose tumoral-a, IL-8 e várias moléculas de adesão.142,143 NF-kB também regula a angiogênese e proliferação e diferenciação de células.
O AP-1 também é regulado pelo estado redox. Na presença de H2O2, alguns íons metálicos podem induzir a ativação de AP-1. O aumento da proporção de GSH / GSSG aumenta a ligação de AP-1 enquanto o GSSG inibe a ligação do DNA da ligação de DNA AP-1.144 do heterodímero Fos / Jun é aumentada pela redução de uma única cisteína conservada no domínio de ligação ao DNA de cada uma das as proteínas, 145, enquanto a ligação de DNA de AP-1 pode ser inibida pelo GSSG em muitos tipos de células, sugerindo que a formação de ligações dissulfureto por resíduos de cisteína inibe a ligação do DNA AP-1. A transdução do sinal 146,147 através do estresse oxidativo é resumida na Figura 2.
CONCLUSÕES
O estresse oxidativo pode surgir da superprodução de ROS por reações metabólicas que usam oxigênio e deslocam o equilíbrio entre oxidante /antioxidante status a favor dos oxidantes. Os ROS são produzidos por atividades metabólicas celulares e fatores ambientais, como poluentes do ar ou fumaça de cigarro. ROS são moléculas altamente reativas devido a elétrons não emparelhados em sua estrutura e reagem com várias macromoléculas biológicas em células, como carboidratos, ácidos nucleicos, lipídios e proteínas, e alteram suas funções. O ROS também afeta a expressão de vários genes por upregulação de fatores de transcrição redox-sensíveis e remodelação da cromatina por alteração na acetilação / desacetilação de histonas. O regulamento do estado redox é crítico para viabilidade celular, ativação, proliferação e função orgânica.
REFERÊNCIAS
1. Valko M, Rhodes CJ, Moncol J, Izakovic M, Mazur M. Radicais livres, metais e antioxidantes no câncer induzido por estresse oxidativo. Chem Biol Interact. 2006; 160: 1 40.
2. Halliwell B, Gutteridge JMC. Radicais livres em biologia e medicina. 3rd ed. Nova York: Oxford University Press; 1999.
3. Marnett LJ. Peroxidação lipídica Dano de DNA por malondialdeído. Mutat Res. 1999; 424: 83 95.
4. Siems WG, Grune T, formação de Esterbauer H. 4-Hydroxynonenal durante a isquemia e reperfusão do intestino delgado de rato. Life Sci. 1995; 57: 785 789.
5. Stadtman ER. Papel das espécies oxidantes no envelhecimento. Curr Med Chem. 2004; 11: 1105 1112.
6. Wang MY, Dhingra K, Hittelman WN, Liehr JG, deAndrade M, Li DH. Adutos putativos de malondialdeído DNA induzidos por peroxidação lipídica em tecidos mamários humanos. Cancer Epidemiol Biomarkers Prev. 1996; 5: 705 710.
7. Jenner P. Estresse oxidativo na doença de Parkinson. Ann Neurol. 2003; 53: S26 S36.
8. Lyras L, Cairns NJ, Jenner A, Jenner P, Halliwell B. Uma avaliação do dano oxidativo a proteínas, lipídios e DNA no cérebro de pacientes com doença de Alzheimer. J Neurochem. 1997; 68: 2061 2069.
9. Sayre LM, Smith MA, Perry G. Química e bioquímica do estresse oxidativo em doenças neurodegenerativas. Curr Med Chem. 2001; 8: 721 738.
10. Toshniwal PK, Zarling EJ. Evidência de aumento da peroxidação lipídica na esclerose múltipla. Neurochem Res. 1992; 17: 205 207.
11. Dhalla NS, Temsah RM, Netticadan T. Role of oxidative stress in cardiovascular disease. J Hypertens. 2000; 18: 655 673.
12. Kasparova S, Brezova V, Valko M, Horecky J, Mlynarik V, et al. Estudo do estresse oxidativo em um modelo de hipoperfusão cerebral crônica em ratos. Neurochem Int. 2005; 46: 601 611.
13. Kerr S, Brosnan MJ, McIntyre M, Reid JL, Dominiczak AF, Hamilton CA. A produção de ânion superóxido é aumentada em um modelo de hipertensão genética: papel do endotélio. Hipertensão. 1999; 33: 1353 1358.
14. Kukreja RC, Hess ML. O sistema de radicais livres de oxigênio: das equações, passando pelas interações membrana-proteína, até danos e proteção cardiovasculares. Cardiovasc Res. 1992; 26: 641 655.
15. Asami S, Manabe H, Miyake J, Tsurudome Y, Hirano T, et al. O tabagismo induz um aumento no dano oxidativo ao DNA, 8-hidroxidesoxiguanosina, em um local central do pulmão humano. Carcinogênese. 1997; 18: 1763 1766.
16. Andreadis AA, Hazen SL, Comhair SA, Erzurum SC. Eventos oxidativos e nitrosativos na asma. Free Radic Biol Med. 2003; 35: 213 225.
17. Comhair SA, Ricci KS, Arroliga M, Lara AR, Dweik RA, et al. Correlação da deficiência sistêmica de superóxido dismutase com a obstrução ao fluxo de ar na asma. Am J Respir Crit Care Med. 2005; 172: 306 313.
18. Comhair SA, Xu W., Ghosh S, Thunnissen FB, Almasan A, et al. Inativação da superóxido dismutase na fisiopatologia da remodelação e reatividade das vias aéreas asmáticos. Am J Pathol. 2005; 166: 663 674.
19. Dut R, Dizdar EA, Birben E, Sackesen C, Soyer OU, Besler T, Kalayci O. Estresse oxidativo e seus determinantes nas vias aéreas de crianças com asma. Alergia. 2008; 63: 1605 1609.
20. Ercan H, Birben E, Dizdar EA, Keskin O, Karaaslan C, et al. Estresse oxidativo e determinantes genéticos e epidemiológicos da lesão oxidativa na asma infantil. J Allergy Clin Immunol. 2006; 118: 1097 1104.
21. Fitzpatrick AM, Teague WG, Holguin F, Yeh M, Brown LA. Programa de pesquisa em asma severa. A homeostase da glutationa das vias aéreas está alterada em crianças com asma grave: evidência de estresse oxidativo. J Allergy Clin Immunol. 2009; 123: 146 152.
22. Miller DM, Buettner GR, Aust SD. Metais de transição como catalisadores de reações de “autoxidação”. Free Radic Biol Med. 1990; 8: 95 108.
23. Dupuy C, Virion A, Ohayon R, Kaniewski J, D me D, Pommier J. Mecanismo de formação de peróxido de hidrogênio catalisado por NADPH oxidase na membrana plasmática da tireóide. J Biol Chem. 1991; 266: 3739 3743.
24. Granger DN. Papel da xantina oxidase e granulócitos na lesão por isquemia-reperfusão. Am J Physiol. 1988; 255: H1269 H1275.
25. Fenton HJH. Oxidação do ácido tartárico na presença de ferro. J Chem Soc. 1984; 65: 899 910.
26. Haber F, Weiss JJ. A decomposição catalítica do peróxido de hidrogênio por sais de ferro. Proc R Soc Lond Ser A. 1934; 147: 332 351.
27. Liochev SI, Fridovich I. O Haber Weiss pedalou 70 anos depois: uma visão alternativa. Redox Rep. 2002; 7: 55 57.
28. Klebanoff SJ. Mieloperoxidase: amigo e inimigo. J Leukoc Biol. 2005; 77: 598 625.
29. Whiteman M, Jenner A, Halliwell B. Hypochlorous acid-induzida modificações de base em DNA isolado de timo de bezerro. Chem Res Toxicol. 1997; 10: 1240 1246.
30. Kulcharyk PA, Heinecke JW. O ácido hipocloroso produzido pelo sistema mieloperoxidase dos fagócitos humanos induz ligações cruzadas covalentes entre o DNA e a proteína. Bioquímica. 2001; 40: 3648 3656.
31. Brennan ML, Wu W, Fu X, Shen Z, Song W, et al. Uma história de duas controvérsias: definir o papel das peroxidases na formação de nitrotirosina in vivo usando peroxidase de eosinófilos e camundongos deficientes em mieloperoxidase e a natureza das espécies reativas de nitrogênio geradas por peroxidase. J Biol Chem. 2002; 277: 17415 17427.
32. Denzler KL, Borchers MT, Crosby JR, Cieslewicz G, Hines EM, et al. A desgranulação extensiva de eosinófilos e a oxidação das proteínas das vias aéreas mediada pela peroxidase não ocorrem em um modelo de inflamação pulmonar com ovalbumina de camundongo. J Immunol. 2001; 167: 1672 1682.
33. van Dalen CJ, Winterbourn CC, Senthilmohan R, Kettle AJ. Nitrito como substrato e inibidor da mieloperoxidase. Implicações para nitração e produção de ácido hipocloroso em locais de inflamação. J Biol Chem. 2000; 275: 11638 11644.
34. Wood LG, Fitzgerald DA, Gibson PG, Cooper DM, Garg ML. A peroxidação lipídica determinada pelos isoprostanos plasmáticos está relacionada à gravidade da doença na asma leve. Lipids. 2000; 35: 967 974.
35. Montuschi P, Corradi M, Ciabattoni G, Nightingale J, Kharitonov SA, Barnes PJ. Aumento de 8-isoprostano, um marcador de estresse oxidativo, no condensado exalado de pacientes asmáticos. Am J Respir Crit Care Med. 1999; 160: 216 220.
36. Church DF, Pryor WA. Química dos radicais livres da fumaça do cigarro e suas implicações toxicológicas. Perspectiva de saúde da Environ. 1985; 64: 111 126.
37. Hiltermann JT, Lapperre TS, van Bree L, Steerenberg PA, Brahim JJ, et al. Inflamação induzida por ozônio avaliada em escarro e fluido de lavagem brônquica de asmáticos: uma nova ferramenta não invasiva em estudos epidemiológicos sobre poluição do ar e asma. Free Radic Biol Med. 1999; 27: 1448 1454.
38. Nightingale JA, Rogers DF, Barnes PJ. Efeito do ozônio inalado no óxido nítrico exalado, função pulmonar e expectoração induzida em indivíduos normais e asmáticos. Tórax. 1999; 54: 1061 1069.
39. Cho AK, Sioutas C, Miguel AH, Kumagai Y, Schmitz DA, et al. Atividade redox de partículas transportadas pelo ar em diferentes locais na Bacia de Los Angeles. Environ Res. 2005; 99: 40 47.
40. Comhair SA, Thomassen MJ, Erzurum SC. Indução diferencial de glutationa peroxidase extracelular e óxido nítrico sintase 2 em vias aéreas de indivíduos saudáveis expostos a 100% O (2) ou fumaça de cigarro. Am J Respir Cell Mol Biol. 2000; 23: 350 354.
41. Matthay MA, Geiser T, Matalon S, Ischiropoulos H. Oxidant-mediated lung lesão na síndrome de angústia respiratória aguda. Crit Care Med. 1999; 27: 2028 2030.
42. Biaglow JE, Mitchell JB, Held K. A importância do peróxido e do superóxido na resposta de raios-X. Int J Radiat Oncol Biol Phys. 1992; 22: 665 669.
43. Chiu SM, Xue LY, Friedman LR, Oleinick NL. Sensibilização mediada por íons de cobre de locais de fixação da matriz nuclear à radiação ionizante. Bioquímica. 1993; 32: 6214 6219.
44. Narayanan PK, Goodwin EH, Lehnert BE. Partículas alfa iniciam a produção biológica de ânions superóxidos e peróxido de hidrogênio em células humanas. Cancer Res. 1997; 57: 3963 3971.
45. Tuttle SW, Varnes ME, Mitchell JB, Biaglow JE. Sensibilidade a oxidantes químicos e radiação em linhagens celulares CHO deficientes na atividade do ciclo das pentoses oxidativas. Int J Radiat Oncol Biol Phys. 1992; 22: 671 675.
46. Guo G, Yan-Sanders Y, Lyn-Cook BD, Wang T, Tamae D, et al. Manganês
expressão de genes mediada por superóxido dismutase em radiação induzida
respostas adaptativas. Mol Cell Biol. 2003; 23: 2362 2378.
47. Azzam EI, de Toledo SM, Spitz DR, Little JB. Metabolismo oxidativo
modula a transdução de sinal e a formação de micronúcleos no espectador
células de fibroblastos humanos normais irradiados com uma partícula. Cancer Res.
2002; 62: 5436 5442.
48. Leach JK, Van Tuyle G, Lin PS, Schmidt-Ullrich R, Mikkelsen RB.
Geração indutiva de radiação ionizante, dependente das mitocôndrias, de geração reativa
oxigênio / nitrogênio. Cancer Res. 2001; 61: 3894 3901.
49. Dent P, Yacoub A, Fisher PB, Hagan MP, Grant S. MAPK caminhos em
respostas de radiação. Oncogene. 2003; 22: 5885 5896.
50. Wei SJ, Botero A, Hirota K, Bradbury CM, Markovina S, et al. Thioredoxin
a translocação nuclear e a interação com o fator redox-1 ativam o fator de transcrição AP-1 em resposta à radiação ionizante. Cancer Res. 2000; 60: 6688 6695.
51. Cadete J, Douki T, Gasparutto D, Ravanat JL. Dano oxidativo ao DNA: formação, medição e características bioquímicas. Mutat Res. 2003; 531: 5 23.
52. Yokoya A, Cunniffe SM, O Neill P. Efeito da hidratação na indução de quebras de fita e lesões de base em filmes de DNA de plasmídeo por radiação gama. J Am Chem Soc. 2002; 124: 8859 8866.
53. Janssen YM, Van Houten B, Borm PJ, Mossman BT. Respostas de células e tecidos ao dano oxidativo. Lab Invest. 1993; 69: 261 274.
54. Iwanaga M, Mori K, Iida T, Urata Y, Matsuo T, et al. Indução dependente do fator nuclear kappa B da gama glutamilcisteína sintetase por radiação ionizante em células de glioblastoma humano T98G. Free Radic Biol Med. 1998; 24: 1256 1268.
55. Stohs SJ, Bagchi D. Mecanismos oxidativos na toxicidade de íons metálicos. Free Radic Biol Med. 1995; 18: 321 336.
56. Leonard SS, Harris GK, Shi X. Estresse oxidativo induzido por metal e transdução de sinal. Free Radic Biol Med. 2004; 37: 1921 1942.
57. Shi H, Shi X, Liu KJ. Mecanismo oxidativo de toxicidade por arsênio e carcinogênese. Mol Cell Biochem. 2004; 255: 67 78.
58. Pi J, Horiguchi S, Sun Y, Nikaido M, Shimojo N, Hayashi T. Um mecanismo potencial para o comprometimento da formação de óxido nítrico causado pela exposição oral prolongada ao arsenato em coelhos. Free Radic Biol Med.2003; 35: 102 ± 113.
59. Rin K, Kawaguchi K, Yamanaka K, Tezuka M, Oku N, Okada S. As quebras de cadeia de DNA induzidas por ácido dimetilarsínico, um metabólito de arsênico inorgânico, são fortemente aumentadas por radicais de ânions superóxido. Biol Pharm Bull. 1995; 18: 45 58.
60. Waalkes MP, Liu J, Ward JM, Diwan LA. Mecanismos subjacentes à carcinogênese do arsênio: hipersensibilidade de camundongos expostos ao arsênio inorgânico durante a gestação. Toxicologia. 2004; 198: 31 38.
61. Schiller CM, Fowler BA, Woods JS. Efeitos do arsênio na ativação da piruvato desidrogenase. Perspectiva de saúde da Environ. 1977; 19: 205 207.
62. Monterio HP, Bechara EJH, Abdalla DSP. Envolvimento dos radicais livres nas porfirias neurológicas e envenenamento por chumbo. Mol Cell Biochem. 1991; 103: 73 83.
63. Tripathi RM, Raghunath R, Mahapatra S. Sangue chumbo e seu efeito nos níveis de Cd, Cu, Zn, Fe e hemoglobina das crianças. Sci Total Environ. 2001; 277: 161 168.
64. Nehru B, Dua R. O efeito do selênio na dieta sobre a neurotoxicidade do chumbo. J Environ Pathol Toxicol Oncol. 1997; 16: 47 50.
65. Reid TM, Feig DI, Loeb LA. Mutagênese por radicais de oxigênio induzidos por metal. Perspectiva de saúde da Environ. 1994; 102 (supl 3): 57 61.
66. Kinnula VL, Crapo JD. Superóxido dismutases no pulmão e doenças pulmonares humanas. Am J Respir Crit Care Med. 2003; 167: 1600 1619.
67. Kinnula VL. Produção e degradação de metabólitos de oxigênio durante estados inflamatórios no pulmão humano. Curr Drug Targets Inflamm Allergy. 2005; 4: 465 470.
68. Zelko IN, Mariani TJ, Folz RJ. Família multigênica de superóxido dismutase: uma comparação das estruturas, evolução e expressão dos genes CuZn-SOD (SOD1), Mn-SOD (SOD2) e EC-SOD (SOD3). Free Radic Biol Med. 2002; 33: 337 349.
69. Kirkman HN, Rolfo M., Ferraris AM, Gaetani GF. Mecanismos de proteção da catalase por NADPH. Cinética e estequiometria. J Biol Chem. 1999; 274: 13908 13914.
70. Floh L. Glutationa peroxidase. Vida Básica Sci. 1988; 49: 663 668.
71. Arthur JR. As glutationa peroxidases. Cell Mol Life Sei. 2000; 57: 1825 1835.
72. Chu FF, Doroshow JH, Esworthy RS. Expressão, caracterização e distribuição nos tecidos de uma nova glutationa peroxidase dependente de selênio celular, GSHPx-GI. J Biol Chem. 1993; 268: 2571 2576.
73. Comhair SA, Bhathena PR, Farver C, Thunnissen FB, Erzurum SC. Indução extracelular de glutationa peroxidase em pulmões asmáticos: evidências para a regulação redox da expressão em células epiteliais das vias aéreas humanas. FASEB J. 2001; 15: 70 78.
74. Gromer S, Urig S, Becker K. O sistema de tiorredoxina da ciência à clínica. Med Res Rev. 2004; 24: 40 89.
75. Kinnula VL, Lehtonen S, Kaarteenaho-Wiik R., Lakari E, P kk P, et al. Expressão celular específica de peroxiredoxinas no pulmão humano e sarcoidose pulmonar. Tórax. 2002; 57: 157 164.
76. Dubuisson M, Vander Stricht D, Clippe A, Etienne F, Nauser T, et al. A peroxirredoxina 5 humana é uma peroxinitrito redutase. FEBS Lett. 2004; 571: 161 165.
77. Holmgren A. Antioxidant function of thioredoxin and glutaredoxin systems. Sinal antioxidante Redox. 2000; 2: 811 820.
78. Dickinson DA, Forman HJ. Glutationa em defesa e sinalização: lições de um pequeno tiol. Ann NY Acad Sei. 2002; 973: 488 504.
79. Sies H. Glutationa e seu papel nas funções celulares. Free Radic Biol Med. 1999; 27: 916 921.
80. Ladner JE, Parsons JF, Rife CL, Gilliland GL, Armstrong RN. Vias evolutivas paralelas para glutationa transferases: estrutura e mecanismo da enzima kappa da classe mitocondrial rGSTK1-1. Bioquímica. 2004; 43: 52 61.
81. Robinson A, Huttley GA, Booth HS, Board PG. Os estudos de modelagem e bioinformática da glutationa transferase da classe kappa humana prevêem uma nova família da terceira transferase com homologia às isomerases procarióticas de 2-hidroxicromene-2-carboxilato. Biochem J. 2004; 379: 541 552.
82. Jakobsson PJ, Morgenstern R, Mancini J, Ford-Hutchinson A, Persson B. Características estruturais comuns de MAPEGda superfamília generalizada de proteínas associadas à membrana com funções altamente divergentes no metabolismo de eicosanóides e glutationa. Protein Sci. 1999; 8: 689 692.
83. Hayes JD, Pulford DJ. A família do supergene da glutationa S-transferase: regulação da GST e a contribuição das isoenzimas para a quimioproteção do câncer e resistência aos medicamentos. Crit Rev Biochem Mol Biol. 1995; 30: 445 600.
84. Armstrong RN. Estrutura, mecanismo catalítico e evolução das glutationa transferases. Chem Res Toxicol. 1997; 10: 2 18.
85. Hayes JD, McLellan LI. A glutationa e as enzimas dependentes da glutationa representam uma defesa coordenada contra o estresse oxidativo. Free Radic Res. 1999; 31: 273 300.
86. Sheehan D, Meade G, Foley VM, Dowd CA. Estrutura, função e evolução das glutationa transferases: implicações para a classificação de membros não mamíferos de uma antiga superfamília de enzimas. Biochem J. 2001; 360: 1 16.
87. Cho SG, Lee YH, Park HS, Ryoo K., Kang KW, et al. A glutationa S-transferase Mu modula os sinais ativados pelo estresse suprimindo a cinase 1 reguladora do sinal de apoptose. J Biol Chem. 2001; 276: 12749 12755.
88. Dorion S, Lambert H, Landry J. A ativação da via de sinalização de p38 por choque térmico envolve a dissociação de glutationa S-transferase Mu de Ask1. J Biol Chem. 2002; 277: 30792 30797.
89. Adler V, Yin Z, Fuchs SY, Benezra M, Rosario L, et al. Regulação da sinalização JNK por GSTp. EMBO J. 1999; 18: 1321 1334.
90. Manevich Y, Feinstein SI, Fisher AB. A ativação da enzima antioxidante 1-CYS peroxirredoxina requer glutationilação mediada por heterodimerização com pGST. Proc Natl Acad Sci US A. 2004; 101: 3780 3785.
91. Bunker VW. Radicais livres, antioxidantes e envelhecimento. Med Lab Sci. 1992; 49: 299 312.
92. Mezzetti A, Lapenna D, Romano F, Costantini F, Pierdomenico SD, et al. Estresse oxidativo sistêmico e sua relação com a idade e doenças. J Am Geriatr Soc. 1996; 44: 823 827.
93. White E, Shannon JS, Patterson RE. Relação entre vitaminas e
uso de suplemento de cálcio e câncer de cólon. Cancer Epidemiol Biomarkers Prev. 1997; 6: 769 774.
94. Masella R, Di Benedetto R, Vari R, Filesi C, Giovannini C. Novos mecanismos de compostos antioxidantes naturais em sistemas biológicos: envolvimento de glutationa e enzimas relacionadas com a glutationa. J Nutr Biochem. 2005; 16: 577 586.
95. Curello S, Ceconi C, Bigoli C, Ferrari R, Albertini A, Guarnieri C. Alterações no status da glutationa cardíaca após isquemia e reperfusão. Experientia. 1985; 41: 42 43.
96. El-Agamey A, Lowe GM, McGarvey DJ, Mortensen A, Phillip DM, Truscott TG. Química do radical carotenóide e propriedades antioxidantes / pró-oxidantes. Arch Biochem Biophys. 2004; 430: 37 48.
97. Rice-Evans CA, Sampson J, Bramley PM, Holloway DE. Por que esperamos que os carotenóides sejam antioxidantes in vivo? Free Radic Res. 1997; 26: 381 398.
98. Niles RM. Vias de sinalização na quimioprevenção dos retinóides e no tratamento do câncer. Mutat Res. 2004; 555: 81 96.
99. Donato LJ, Noy N. Supressão do crescimento do carcinoma mamário por ácido retinóico: os genes pró-apoptóticos são alvos para o receptor do ácido retinóico e a sinalização da proteína II de ligação ao ácido retinóico celular. Cancer Res. 2005; 65: 8193 8199.
100. Niizuma H, Nakamura Y, Ozaki T, Nakanishi H, Ohira M, et al. O Bcl-2 é um regulador chave para a morte celular apoptótica induzida pelo ácido retinóico no neuroblastoma. Oncogene. 2006; 25: 5046 5055.
101. Dalton TP, Shertzer HG, Puga A. Regulação da expressão do gene por oxigênio reativo. Ann Rev Pharmacol Toxicol. 1999; 39: 67 101.
102. Scandalios JG. Respostas genômicas ao estresse oxidativo. In: Meyers RA, ed. Enciclopédia de Biologia Celular e Molecular e Medicina Molecular. Vol 5. 2ª ed. Weinheim, Alemanha: Wiley-VCH; 2004: 489 512.
103. Ghosh R, Mitchell DL. Efeito do dano oxidativo ao DNA em elementos promotores na ligação do fator de transcrição. Nucleic Acids Res. 1999; 27: 3213 3218.
104. Marietta C, Gulam H, Brooks PJ. Uma única lesão de 8, 50-ciclo-20-desoxiadenosina em uma caixa TATA impede a ligação da proteína de ligação a TATA e reduz fortemente a transcrição in vivo. Reparo de DNA (Amst). 2002; 1: 967 975.
105. Jackson AL, Chen R, Loeb LA. Indução da instabilidade dos microsatérios
por dano oxidativo ao DNA. Proc Natl Acad Sci US A. 1998; 95: 12468 12473.
106. Caldecott KW. Interações proteína-proteína durante o reparo de quebra de fita simples de DNA de mamíferos. Biochem Soc Trans. 2003; 31: 247 251.
107. Cooke MS, Evans MD, Dizdaroglu M, Lunec J. Oxidative DNA damage: engines, mutation, and disease. FASEB J. 2003; 17: 1195 1214.
108. Jones PL, Wolffe AP. Relações entre a organização da cromatina e a metilação do DNA na determinação da expressão gênica. Semin Cancer Biol. 1999; 9: 339 347.
109. Girotti AW. Mecanismos de peroxidação lipídica. J Free Radic Biol Med. 1985; 1: 87 95.
110. Siu GM, Draper HH. Metabolismo do malonaldeído in vivo e in vitro. Lipids. 1982; 17: 349 355.
111. Esterbauer H, Koller E, Slee RG, Koster JF. Possível envolvimento do produto da peroxidação lipídica 4-hidroxinonenal na formação de cromolipídeos fluorescentes. Biochem J. 1986; 239: 405 409.
112. Hagihara M, Nishigaki I, Maseki M, Yagi K. Alterações dependentes da idade nos níveis de peróxido de lipídio nas frações de lipoproteína do soro humano. J Gerontol. 1984; 39: 269 272.
113. Keller JN, Mark RJ, Bruce AJ, Blanc E, Rothstein JD, et al. 4- O hidroxinonenal, um produto aldeídico da peroxidação lipídica da membrana, prejudica o transporte de glutamato e a função mitocondrial nos sinaptossomas. Neurociências. 1997; 806: 85 96.
114. Uchida K, Shiraishi M, Naito Y, Torii Y, Nakamura Y, Osawa T. Activation of stress signaling pathways by the end product of lipid peroxidation. O 4-hidroxi-2-nonenal é um potencial indutor da produção de peróxido intracelular. J Biol Chem. 1999; 274: 2234 2242.
115. Suc I, Meilhac O, Lajoie-Mazenc I, Vandaele J, Jurgens G, Salvayre R, Negre-Salvayre A. Activation of EGF receptor by oxidized LDL. FASEB J. 1998; 12: 665 671.
116. Tsukagoshi H, Kawata T, Shimizu Y, Ishizuka T, Dobashi K, Mori M. 4-Hydroxy-2-nonenal aumenta a produção de fibronectina por fibroblastos de pulmão humano IMR-90 parcialmente via ativação do sinal extracelular ligado ao receptor do fator de crescimento epidérmico via da quinase p44 / 42 regulada. Toxicol Appl Pharmacol. 2002; 184: 127 135.
117. Montuschi P, Collins JV, Ciabattoni G, Lazzeri N, Corradi M, Kharitonov SA, Barnes PJ. 8-isoprostano exalado como biomarcador in vivo de estresse oxidativo pulmonar em pacientes com DPOC e fumantes saudáveis. Am J Respir Crit Care Med. 2000; 162: 1175 1177.
118. Morrison D, Rahman I, Lannan S, MacNee W. Permeabilidade epitelial, inflamação e estresse oxidante nos espaços aéreos de fumantes. Am J Respir Crit Care Med. 1999; 159: 473 479.
119. Nowak D, Kasielski M, Antczak A, Pietras T, Bialasiewicz P. Aumento do conteúdo de substâncias reativas ao ácido tiobarbitúrico e peróxido de hidrogênio no condensado da respiração expirada de pacientes com doença pulmonar obstrutiva crônica estável: nenhum efeito significativo do tabagismo. Respir Med. 1999; 93: 389 396.
120. Kelly FJ, Mudway IS. Oxidação de proteínas na interface ar-pulmão. Aminoácidos. 2003; 25: 375 396.
121. Dean RT, Roberts CR, Jessup W. Fragmentation of extracellular and intracellular polypeptides by free radicais. Prog Clin Biol Res. 1985; 180: 341 350.
122. Keck RG. O uso de hidroperóxido de t-butila como uma sonda para a oxidação de metionina em proteínas. Anal Biochem. 1996; 236: 56 62.
123. Davies KJ. Dano e degradação de proteínas por radicais de oxigênio. I. Aspectos gerais. J Biol Chem. 1987; 262: 9895 9901.
124. Stadtman ER. Oxidação de proteínas catalisadas por íons metálicos: mecanismo bioquímico e conseqüências biológicas. Radic Biol Med gratuito.
1990; 9: 315 325.
125. Fucci L, Oliver CN, Coon MJ, Stadtman ER. Inativação de enzimas metabólicas chave por reações de oxidação de função mista: possível implicação no turnover de proteínas e envelhecimento. Proc Natl Acad Sci US A. 1983; 80: 1521-1525.
126. Stadtman ER, Moskovitz J, Levine RL. Oxidação de resíduos de metionina de proteínas: consequências biológicas. Sinal antioxidante Redox. 2003; 5: 577 582.
127. Stadtman ER, Levine RL. Oxidação mediada por radicais livres de aminoácidos livres e resíduos de aminoácidos em proteínas. Aminoácidos. 2003; 25: 207 218.
128. Stadtman ER. Oxidação de proteínas no envelhecimento e doenças relacionadas com a idade. Ann NY Acad Sei. 2001; 928: 22 38.
129. Shacter E. Quantificação e significado da oxidação de proteínas em amostras biológicas. Drug Metab Rev. 2000; 32: 307 326.
130. Poli G, Leonarduzzi G, Biasi F, Chiarpotto E. Oxidative stress and cell signaling. Curr Med Chem. 2004; 11: 1163 1182.
131. Neufeld G, Cohen T, Gengrinovitch S, Poltorak Z. Vascular endothelial growth factor (VEGF) and its receptors. FASEB J. 1999; 13: 9 22.
132. Sundaresan M, Yu ZX, Ferrans VJ, Sulciner DJ, Gutkind JS, et al. Regulação da geração de espécies reativas de oxigênio em fibroblastos por Rac1. Biochem J. 1996; 318: 379 382.
133. Sun T, Oberley LW. Regulação redox de ativadores transcricionais. Free Radic Biol Med. 1996; 21: 335 348.
134. Klatt P, Molina EP, De Lacoba MG, Padilla CA, Martinez-Galesteo E, Barcena JA, Lamas S. Redox regulação de c-Jun DNA binding by reversible S-glutathiolation. FASEB J. 1999; 13: 1481 1490.
135. Reynaert NL, Ckless K, Guala AS, Wouters EF, Van der Vliet A, Janssen Heininger
YM. Detecção in situ de proteínas S-glutationiladas após derivatização de cisteína catalisada por glutaredoxina-1. Biochim Biophys Acta. 2006; 1760: 380 387.
136. Reynaert NL, Wouters EF, Janssen-Heininger YM. Modulação de glutaredoxina-1
expressão em um modelo de camundongo de doença alérgica das vias aéreas. Am J Respir Cell Mol Biol. 2007; 36: 147 151.
137. Filomeni G, Rotilio G, Ciriolo MR. Sinalização celular e o sistema redox da glutationa. Biochem Pharmacol. 2002; 64: 1057 1064.
138. Pande V, Ramos MJ. Reconhecimento molecular da prostaglandina J (15) 12,14-desoxidelta (2) pelo fator nuclear kappa B e outras proteínas celulares. Bioorg Med Chem Lett. 2005; 15: 4057 4063.
139. Perkins ND. Integração de vias de sinalização celular com função NF-kappaB e IKK. Nat Rev Mol Cell Biol. 2007; 8: 49 62.
140. Gilmore TD. Introdução ao NF-kappaB: jogadores, percursos, perspectivas. Oncogene. 2006; 25: 6680 6684.
141. Hirota K, Murata M, Sachi Y, Nakamura H, Takeuchi J, Mori K, Yodoi J. Papéis distintos da tioredoxina no citoplasma e no núcleo. Um mecanismo de duas etapas de regulação redox do fator de transcrição NF-kappaB. J Biol Chem. 1999; 274: 27891 27897.
142. Ward PA. Papel do complemento, quimiocinas e citocinas regulatórias na lesão pulmonar aguda. Ann NY Acad Sei. 1996; 796: 104 112.
143. Akira S, Kishimoto A. NF-IL6 e NF-kB na regulação do gene de citocina. Adv Immunol. 1997; 65: 1 46.
144. Meyer M, Schreck R, Baeuerle PA. H2O2 e antioxidantes têm efeitos opostos na ativação de NF-kappa B e AP-1 em células intactas: AP-1 como fator responsivo a antioxidante secundário. EMBO J. 1993; 12: 2005 2015.
145. Abate C, Patel L, Rausher FJ, Curran T. Redox regulação de fos e jun DNA-binding activity in vitro. Ciência. 1990; 249: 1157 1161.
146. Galter D, Mihm S, Droge W. Distinct effects of glutationa disulfide on the nuclear transcription fatores kB and the activator protein-1. Eur J Biochem. 1994; 221: 639 648.
147. Hirota K, Matsui M, Iwata S, Nishiyama A, Mori K, Yodoi J. A atividade transcricional de AP-1 é regulada por uma associação direta entre tioredoxina e Ref-1. Proc Natl Acad Sci US A. 1997; 94: 3633 3638.
Escopo de prática profissional *
As informações aqui contidas em "El Paso, TX Stress Oxidativo e Defesa Antioxidante" não se destina a substituir um relacionamento individual com um profissional de saúde qualificado ou médico licenciado e não é um conselho médico. Incentivamos você a tomar decisões de saúde com base em sua pesquisa e parceria com um profissional de saúde qualificado.
Informações do blog e discussões de escopo
Nosso escopo de informações limita-se à Quiropraxia, musculoesquelética, medicamentos físicos, bem-estar, contribuindo distúrbios viscerossomáticos dentro de apresentações clínicas, dinâmica clínica de reflexo somatovisceral associada, complexos de subluxação, questões de saúde sensíveis e/ou artigos, tópicos e discussões de medicina funcional.
Nós fornecemos e apresentamos colaboração clínica com especialistas de várias disciplinas. Cada especialista é regido por seu escopo profissional de prática e sua jurisdição de licenciamento. Usamos protocolos funcionais de saúde e bem-estar para tratar e apoiar o cuidado de lesões ou distúrbios do sistema músculo-esquelético.
Nossos vídeos, postagens, tópicos, assuntos e insights abrangem assuntos clínicos, problemas e tópicos relacionados e apoiam direta ou indiretamente nosso escopo de prática clínica.*
Nosso escritório tentou razoavelmente fornecer citações de apoio e identificou o estudo de pesquisa relevante ou estudos que apóiam nossas postagens. Fornecemos cópias dos estudos de pesquisa de apoio à disposição dos conselhos regulatórios e do público mediante solicitação.
Entendemos que cobrimos questões que requerem uma explicação adicional de como isso pode ajudar em um plano de cuidados ou protocolo de tratamento específico; portanto, para discutir melhor o assunto acima, sinta-se à vontade para perguntar Dr. Alex Jiménez, DC, ou contacte-nos 915-850-0900.
Estamos aqui para ajudar você e sua família.
Bênçãos
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
o email: coach@elpasofunctionalmedicine. com
Licenciado como Doutor em Quiropraxia (DC) em Texas & Novo México*
Licença DC do Texas # TX5807, Novo México DC Licença # NM-DC2182
Licenciada como enfermeira registrada (RN*) in Florida
Licença da Flórida Licença RN # RN9617241 (Controle nº 3558029)
Status compacto: Licença Multiestadual: Autorizado para exercer em Estados 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Meu cartão de visita digital