Inflamação neurogênica, ou NI, é o processo fisiológico em que os mediadores são liberados diretamente dos nervos cutâneos para iniciar uma resposta inflamatória. Isso resulta na criação de reações inflamatórias locais, incluindo eritema, inchaço, aumento de temperatura, sensibilidade e dor. Fibras C somáticas aferentes não mielinizadas, que respondem a estímulos mecânicos e químicos de baixa intensidade, são amplamente responsáveis pela liberação desses mediadores inflamatórios.
Quando estimuladas, essas vias nervosas nos nervos cutâneos liberam neuropeptídeos energéticos, ou substância P e peptídeo relacionado ao gene da calcitonina (CGRP), rapidamente no microambiente, desencadeando uma série de respostas inflamatórias. Existe uma distinção significativa na inflamação imunogênica, que é a primeira resposta protetora e reparadora feita pelo sistema imunológico quando um patógeno entra no corpo, enquanto a inflamação neurogênica envolve uma conexão direta entre o sistema nervoso e as respostas inflamatórias. Embora a inflamação neurogênica e a inflamação imunológica possam existir concomitantemente, as duas não são clinicamente indistinguíveis. O objetivo do artigo abaixo é discutir o mecanismo da inflamação neurogênica e o papel do sistema nervoso periférico na defesa do hospedeiro e na imunopatologia.
Conteúdo
Inflamação neurogênica O papel do sistema nervoso periférico na defesa e imunopatologia do hospedeiro
Sumário
Os sistemas nervoso e imunológico periférico são tradicionalmente considerados como funções separadas. Essa linha está, no entanto, se tornando cada vez mais obscurecida por novos insights sobre a inflamação neurogênica. Os neurônios nociceptores possuem muitas das mesmas vias de reconhecimento molecular do perigo que as células imunes e, em resposta ao perigo, o sistema nervoso periférico se comunica diretamente com o sistema imunológico, formando um mecanismo protetor integrado. A rede densa de inervação de fibras sensoriais e autonômicas em tecidos periféricos e a alta velocidade de transdução neural permitem rápida modulação neurogênica local e sistêmica da imunidade. Os neurônios periféricos também parecem desempenhar um papel significativo na disfunção imune em doenças autoimunes e alérgicas. Portanto, a compreensão da interação coordenada de neurônios periféricos com células imunes pode promover abordagens terapêuticas para aumentar a defesa do hospedeiro e suprimir a imunopatologia.
Introdução
Dois mil anos atrás, Celsus definiu a inflamação como envolvendo quatro sinais cardeais Dolor (dor), Calor (calor), Rubor (vermelhidão) e Tumor (inchaço), uma observação que indica que a ativação do sistema nervoso foi reconhecida como parte integrante de inflamação. No entanto, a dor tem sido pensada principalmente desde então, apenas como um sintoma, e não como participante na geração da inflamação. Nessa perspectiva, mostramos que o sistema nervoso periférico desempenha um papel direto e ativo na modulação da imunidade inata e adaptativa, de modo que os sistemas imunológico e nervoso podem ter uma função protetora integrada comum na defesa do hospedeiro e na resposta à lesão tecidual, uma intrincada interação que também pode levar à patologia em doenças alérgicas e autoimunes.
A sobrevivência dos organismos é criticamente dependente da capacidade de montar uma defesa contra os danos potenciais de danos e infecções nos tecidos. A defesa do hospedeiro envolve tanto o comportamento de evitação para remover o contato com um ambiente perigoso (nocivo) (uma função neural) e a neutralização ativa de patógenos (uma função imunológica). Tradicionalmente, o papel do sistema imunológico no combate a agentes infecciosos e na reparação de lesões teciduais tem sido considerado bastante distinto daquele do sistema nervoso, que transduz sinais ambientais e internos prejudiciais em atividade elétrica para produzir sensações e reflexos (Fig. 1). Propomos que esses dois sistemas são, na verdade, componentes de um mecanismo de defesa unificado. O sistema nervoso somatossensorial está idealmente posicionado para detectar o perigo. Em primeiro lugar, todos os tecidos que estão altamente expostos ao ambiente externo, como as superfícies epiteliais da pele, pulmões, trato urinário e digestivo, são densamente inervados por nociceptores, fibras sensoriais produtoras de dor de alto limiar. Em segundo lugar, a transdução de estímulos externos nocivos é quase instantânea, ordens de magnitude mais rápida do que a mobilização do sistema imunológico inato e, portanto, pode ser o "primeiro a responder" na defesa do hospedeiro.
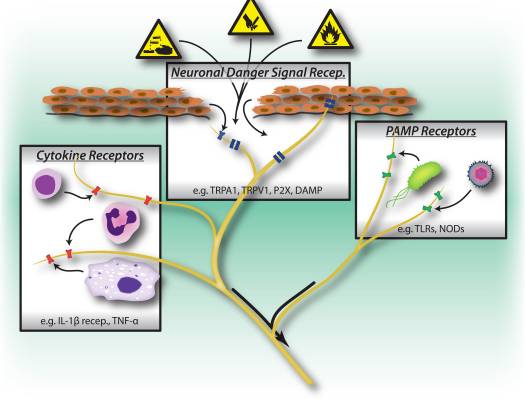
Figura 1: Estímulos nocivos, vias de reconhecimento microbiano e inflamatório desencadeiam a ativação do sistema nervoso periférico. Os neurônios sensoriais possuem vários meios de detectar a presença de estímulos nocivos / prejudiciais. 1) Receptores de sinal de perigo, incluindo canais TRP, canais P2X e receptores de padrão molecular associado a perigo (DAMP) reconhecem sinais exógenos do ambiente (por exemplo, calor, acidez, produtos químicos) ou sinais endógenos de perigo liberados durante trauma / lesão tecidual (por exemplo, ATP, ácido úrico, hidroxinonenais). 2) Receptores de reconhecimento de padrões (PRRs), como receptores Toll-like (TLRs) e receptores semelhantes a Nod (NLRs) reconhecem padrões moleculares associados a patógenos (PAMPs) liberados por bactérias ou vírus invasores durante a infecção. 3) Os receptores de citocinas reconhecem os fatores secretados pelas células imunes (por exemplo, IL-1beta, TNF-alfa, NGF), que ativam quinases de mapa e outros mecanismos de sinalização para aumentar a excitabilidade da membrana.
Além das entradas ortodrômicas para a medula espinhal e o cérebro da periferia, os potenciais de ação em neurônios nociceptores também podem ser transmitidos antidromicamente em pontos de ramificação que voltam para a periferia, o reflexo do axônio. Estes, juntamente com as despolarizações locais sustentadas, levam a uma liberação rápida e local de mediadores neurais de ambos os axônios periféricos e terminais (Fig. 2) 1. Experimentos clássicos de Goltz (em 1874) e de Bayliss (em 1901) mostraram que raízes dorsais eletricamente estimulantes induz vasodilatação cutânea, o que levou ao conceito de inflamação neurogênica , independente daquela produzida pelo sistema imunológico (fig. 3).
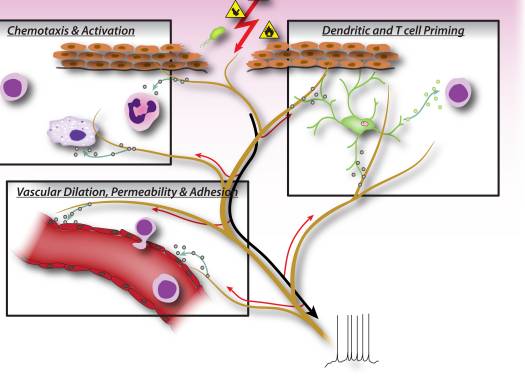
Figura 2: Fatores neuronais liberados pelos neurônios sensitivos do nociceptor dirigem diretamente a quimiotaxia de leucócitos, a hemodinâmica vascular e a resposta imune. Quando estímulos nocivos ativam os sinais aferentes nos nervos sensoriais, geram-se reflexos axônicos antidrómicos que induzem a liberação de neuropeptídeos nos terminais periféricos dos neurônios. Estes mediadores moleculares possuem várias ações inflamatórias: 1) Quimiotaxia e ativação de neutrófilos, macrófagos e linfócitos para o local da lesão, e degranulação de mastócitos. 2) Sinalização para células endoteliais vasculares para aumento do fluxo sanguíneo, vazamento vascular e edema. Isso também permite o recrutamento mais fácil de leucócitos inflamatórios. 3) Injecção de células dendríticas para conduzir a diferenciação subsequente de células T auxiliares nos subtipos Th2 ou Th17.

Figura 3: Cronograma de avanços na compreensão dos aspectos neurogênicos da inflamação de Celso até os dias atuais.
A inflamação neurogênica é mediada pela liberação dos neuropeptídeos peptídeo relacionado ao gene da calcitonina (CGRP) e substância P (SP) dos nociceptores, que atuam diretamente nas células endoteliais vasculares e do músculo liso 2�5. O CGRP produz efeitos vasodilatadores 2, 3, enquanto o SP aumenta a permeabilidade capilar levando ao extravasamento de plasma e edema 4, 5, contribuindo para o rubor, calor e tumor de Celsus. No entanto, os nociceptores liberam muitos neuropeptídeos adicionais (banco de dados online: www.neuropeptídeos.nl/), incluindo adrenomedulina, neurocininas A e B, peptídeo intestinal vasoativo (VIP), neuropeptídeo (NPY) e peptídeo liberador de gastrina (GRP), bem como outros mediadores moleculares, como glutamato, óxido nítrico (NO) e citocinas, como eotaxina 6
Agora reconhecemos que os mediadores liberados dos neurônios sensoriais na periferia não atuam apenas na vasculatura, mas também atraem e ativam diretamente as células imunes inatas (mastócitos, células dendríticas) e células imunes adaptativas (linfócitos T) 7 12. No cenário agudo de dano tecidual, conjeturamos que a inflamação neurogênica é protetora, facilitando a cicatrização fisiológica de feridas e a defesa imunológica contra patógenos por meio da ativação e do recrutamento de células imunológicas. No entanto, essas comunicações neuro-imunes também provavelmente desempenham papéis importantes na fisiopatologia de doenças alérgicas e autoimunes, amplificando as respostas imunes patológicas ou mal-adaptativas. Em modelos animais de artrite reumatóide, por exemplo, Levine e colegas demonstraram que a denervação da articulação leva a uma atenuação notável na inflamação, que é dependente da expressão neural da substância P 13, 14. Em estudos recentes de inflamação alérgica das vias aéreas, colite e psoríase, os neurônios sensoriais primários desempenham um papel central em iniciar e aumentar a ativação da imunidade inata e adaptativa 15 17.
Propomos, portanto, que o sistema nervoso periférico não apenas desempenhe um papel passivo na defesa do hospedeiro (detecção de estímulos nocivos e início do comportamento de evitação), mas também um papel ativo em conjunto com o sistema imunológico na modulação das respostas e combate de estímulos, um papel que pode ser subvertido para contribuir para a doença.
Caminhos Compartilhados de Reconhecimento de Perigo nos Sistemas Imunológicos Nervosos e Nervosos Periféricos
Os neurônios sensoriais periféricos são adaptados para reconhecer o perigo ao organismo em virtude de sua sensibilidade a estímulos químicos mecânicos, térmicos e irritantes intensos (Fig. 1). Os canais iônicos do potencial receptor de transientes (TRP) são os mediadores moleculares mais amplamente estudados da nocicepção, conduzindo a entrada não seletiva de cátions após ativação por vários estímulos nocivos. O TRPV1 é ativado por altas temperaturas, baixo pH e capsaicina, o componente irritante vallinoide da pimenta 18. O TRPA1 medeia a detecção de produtos químicos reativos, incluindo irritantes ambientais, como gás lacrimogêneo e isotiocianatos industriais 19, mas, mais importante, também é ativado durante a lesão tecidual por sinais moleculares endógenos incluindo 4-hidroxinonenal e prostaglandinas 20, 21.
É interessante notar que os neurônios sensoriais compartilham muitas das vias do receptor de reconhecimento molecular do patógeno e do perigo como as células imunes inatas, o que permite que eles também detectem patógenos (Fig. 1). No sistema imune, os patógenos microbianos são detectados por receptores de reconhecimento de padrões codificados (PRRs) germinais, que reconhecem padrões moleculares associados a patógenos exógenos (PAMPs) amplamente conservados. Os primeiros PRRs a serem identificados eram membros da família TLR, que se ligam a leveduras, componentes de parede celular derivados de bactérias e RNA viral 22. Após a ativação de PRR, são ativadas vias de sinalização a jusante que induzem a produção de citocinas e a ativação da imunidade adaptativa. Além dos TLRs, as células imunes inatas são ativadas durante a lesão tecidual por sinais de perigo derivados endógenos, também conhecidos como padrões moleculares associados a danos (DAMPs) ou alarmes 23, 24. Esses sinais de perigo incluem HMGB1, ácido úrico e proteínas de choque térmico liberadas pelas células mortas durante a necrose, ativando as células imunológicas durante as respostas inflamatórias não infecciosas.
PRRs incluindo TLRs 3, 4, 7 e 9 são expressos por neurônios nociceptores, e a estimulação por ligantes de TLR leva à indução de correntes internas e à sensibilização de nociceptores a outros estímulos de dor 25 27. Além disso, a ativação de neurônios sensoriais pelo ligante TLR7 imiquimod leva à ativação de uma via sensorial específica de coceira 25. Esses resultados indicam que a dor associada à infecção e coceira podem ser parcialmente devido à ativação direta de neurônios por fatores derivados de patógenos, que por sua vez ativar células imunes por meio da liberação periférica de moléculas de sinalização neuronal.
O principal DAMP / alarmina liberado durante a lesão celular é o ATP, que é reconhecido por receptores purinérgicos em neurônios nociceptores e células imunes 28. Os receptores purinérgicos são compostos de duas famílias: receptores P30X, canais de cátions controlados por ligante e receptores P2Y, receptores acoplados à proteína G. Em neurônios nociceptores, o reconhecimento de ATP ocorre por meio de P2X2, levando à rápida densensibilização das correntes catiônicas e da dor 3, 28 (Fig. 30), enquanto os receptores P1Y contribuem para a ativação do nociceptor pela sensibilização do TRP e dos canais de sódio dependentes de voltagem. Em macrófagos, a ligação do ATP aos receptores P2X2 leva à hiperpolarização e ativação a jusante do inflamassoma, um complexo molecular importante na geração de IL-7beta e IL-1 18. Portanto, o ATP é um potente sinal de perigo que ativa tanto os neurônios periféricos quanto o inato imunidade durante a lesão, e algumas evidências até sugerem que os neurônios expressam partes da maquinaria molecular do inflamassoma 29.
O outro lado dos sinais de perigo nos nociceptores é o papel dos canais TRP na ativação das células imunes. O TRPV2, um homólogo do TRPV1 ativado por calor nocivo, é expresso em altos níveis nas células imunes inatas 32. A ablação genética de TRPV2 levou a defeitos na fagocitose macrofágica e eliminação de infecções bacterianas 32. Os mastócitos também expressam canais TRPV, que podem mediar diretamente sua degranulação 33. Resta determinar se os sinais de perigo endógenos ativam as células imunes de maneira similar aos nociceptores.
Um meio importante de comunicação entre as células imunológicas e os neurônios nociceptores são as citocinas. Após a ativação dos receptores de citocinas, as vias de transdução de sinal são ativadas em neurônios sensoriais, levando à fosforilação a jusante de proteínas de membrana, incluindo TRP e canais dependentes de voltagem (Fig. 1). A sensibilização resultante dos nociceptores significa que estímulos mecânicos e térmicos normalmente inócuos podem agora ativar os nociceptores. A interleucina 1 beta e o TNF-alfa são duas citocinas importantes liberadas pelas células imunes inatas durante a inflamação. A IL-1beta e o TNF-alfa são detectados diretamente pelos nociceptores que expressam os receptores cognatos, induzem a ativação das quinases do mapa p38, levando ao aumento da excitabilidade da membrana 34 36. O fator de crescimento nervoso (NGF) e a prostaglandina E (2) também são os principais mediadores inflamatórios liberados pelas células do sistema imunológico que atuam diretamente nos neurônios sensoriais periféricos para causar sensibilização. Um efeito importante da sensibilização do nociceptor por fatores imunológicos é uma liberação aumentada de neuropeptídeos nos terminais periféricos que ativam ainda mais as células imunológicas, induzindo assim um ciclo de feedback positivo que impulsiona e facilita a inflamação.
Controle do Sistema Nervoso Sensorial da Imunidade Inata e Adaptativa
Nas fases iniciais da inflamação, os neurônios sensoriais sinalizam para os mastócitos e células dendríticas residentes no tecido, que são células imunes inatas importantes para iniciar a resposta imune (Fig. 2). Estudos anatômicos têm mostrado uma aposição direta de terminais com mastócitos, bem como com células dendríticas, e os neuropeptídeos liberados de nociceptores podem induzir degranulação ou produção de citocinas nessas células 7, 9, 37. Essa interação desempenha um papel importante nas vias aéreas alérgicas inflamação e dermatite 10 12.
Durante a fase efetora da inflamação, as células imunes precisam encontrar seu caminho para o local específico da lesão. Muitos mediadores liberados de neurônios sensoriais, neuropeptídeos, quimiocinas e glutamato, são quimiotáticos para neutrófilos, eosinófilos, macrófagos e células T e aumentam a adesão endotelial que facilita o homing de células imunes 6, 38-41 (Fig. 2). Além disso, algumas evidências indicam que os neurônios podem participar diretamente da fase efetora, uma vez que os próprios neuropeptídeos podem ter funções antimicrobianas diretas 42.
Moléculas de sinalização derivadas neuronalmente também podem direcionar o tipo de inflamação, contribuindo para a diferenciação ou especificação de diferentes tipos de células T imunes adaptativas. Um antígeno é fagocitado e processado por células imunes inatas, que então migram para o linfonodo mais próximo e apresentam o peptídeo antigênico às células T virgens. Dependendo do tipo de antígeno, das moléculas coestimulatórias na célula imune inata e das combinações de citocinas específicas, as células T na ve amadurecem em subtipos específicos que melhor servem ao esforço inflamatório para eliminar o estímulo patogênico. As células T CD4, ou células T auxiliares (Th), podem ser divididas em quatro grupos principais, Th1, Th2, Th17 e células T reguladoras (Treg). As células Th1 estão principalmente envolvidas na regulação das respostas imunes a microrganismos intracelulares e doenças autoimunes específicas de órgãos; Th2 são críticos para a imunidade contra patógenos extracelulares, como helmintos, e são responsáveis por doenças inflamatórias alérgicas; As células Th17 desempenham um papel central na proteção contra desafios microbianos, como bactérias e fungos extracelulares; As células Tregs estão envolvidas na manutenção da autotolerância e na regulação das respostas imunológicas. Este processo de maturação de células T parece ser fortemente influenciado por mediadores neuronais sensoriais. Neuropeptídeos, como CGRP e VIP, podem influenciar as células dendríticas em direção a uma imunidade do tipo Th2 e reduzir a imunidade do tipo Th1, promovendo a produção de certas citocinas e inibindo outras, bem como reduzindo ou aumentando a migração das células dendríticas para os linfonodos locais 8 , 10, 43. Os neurônios sensoriais também contribuem consideravelmente para a inflamação alérgica (principalmente conduzida por Th2) 17. Além de regular as células Th1 e Th2, outros neuropeptídeos, como SP e hemocinina-1, podem conduzir a resposta inflamatória mais para Th17 ou Treg 44, 45, o que significa que os neurônios também podem estar envolvidos na regulação da resolução inflamatória. Em imunopatologias, como colite e psoríase, o bloqueio de mediadores neuronais como a substância P pode amortecer significativamente as células T e os danos imunomediados 15-17, embora antagonizar um mediador possa por si só ter um efeito limitado sobre a inflamação neurogênica.
Considerando que as moléculas sinalizadoras liberadas pelas fibras nervosas sensoriais periféricas regulam não apenas pequenos vasos sangüíneos, mas também a quimiotaxia, homing, maturação e ativação de células imunes, está se tornando claro que as interações neuro-imunes são muito mais intrincadas do que se pensava anteriormente. 2). Além disso, é bastante concebível que não sejam mediadores neurais individuais, mas sim combinações específicas de moléculas de sinalização liberadas de nociceptores que influenciam diferentes estágios e tipos de respostas imunes.
Controle Reflexo Autônomo da Imunidade
Um papel para um circuito reflex do sistema nervoso autônomo colinérgico na regulação das respostas imunes periféricas também parece proeminente 46. O vago é o principal nervo parassimpático que conecta o tronco encefálico aos órgãos viscerais. Trabalhos de Kevin Tracey e outros apontam para respostas antiinflamatórias generalizadas potentes no choque séptico e endotoxemia, desencadeadas por uma atividade do nervo vagal eferente levando a uma supressão de macrófagos periféricos 47-49. O vago ativa os neurônios do gânglio celíaco adrenérgico periférico que inervam o baço, levando à liberação de acetilcolina, que se liga aos receptores nicotínicos alfa-7 nos macrófagos do baço e do trato gastrointestinal. Isso induz a ativação da via de sinalização JAK2 / STAT3 SOCS3, que suprime poderosamente a transcrição do TNF-alfa 47. O gânglio celíaco adrenérgico também se comunica diretamente com um subconjunto de células T de memória produtoras de acetilcolina, que suprimem macrófagos inflamatórios 48.
Células T assassinas naturais invariantes (iNKT) são um subconjunto especializado de células T que reconhecem lipídios microbianos no contexto de CD1d em vez de antígenos peptídicos. As células NKT são uma população-chave de linfócitos envolvidos no combate de patógenos infecciosos e na regulação da imunidade sistêmica. As células NKT residem e traficam principalmente através da vasculatura e sinusóides do baço e do fígado. Os nervos beta-adrenérgicos simpáticos no fígado sinalizam diretamente para modular a atividade das células NKT 50. Durante um modelo de rato de acidente vascular cerebral (MCAO), por exemplo, a mobilidade das células NKT do fígado foi visivelmente suprimida, o que foi revertido por denervação simpática ou antagonistas beta-adrenérgicos. Além disso, essa atividade imunossupressora dos neurônios noradrenérgicos nas células NKT levou ao aumento da infecção sistêmica e da lesão pulmonar. Portanto, sinais eferentes de neurônios autônomos podem mediar uma imunossupressão potente.

Insight do Dr. Alex Jimenez
A inflamação neurogênica é uma resposta inflamatória local gerada pelo sistema nervoso. Acredita-se que desempenha um papel fundamental na patogênese de uma variedade de problemas de saúde, incluindo, enxaqueca, psoríase, asma, fibromialgia, eczema, rosácea, distonia e sensibilidade química múltipla. Embora a inflamação neurogênica associada ao sistema nervoso periférico tenha sido amplamente pesquisada, o conceito de inflamação neurogênica dentro do sistema nervoso central ainda precisa de mais pesquisas. De acordo com várias pesquisas, no entanto, acredita-se que as deficiências de magnésio sejam a principal causa de inflamação neurogênica. O artigo a seguir demonstra uma visão geral dos mecanismos de inflamação neurogênica no sistema nervoso, o que pode ajudar os profissionais de saúde a determinar a melhor abordagem de tratamento para cuidar de uma variedade de problemas de saúde associados ao sistema nervoso.
Conclusões
Quais são os respectivos papéis específicos dos sistemas nervoso somatossensorial e autônomo na regulação da inflamação e do sistema imunológico (Fig. 4)? A ativação de nociceptores leva a reflexos axônicos locais, que recrutam e ativam localmente as células do sistema imunológico e, portanto, são principalmente pró-inflamatórios e espacialmente confinados. Em contraste, a estimulação autonômica leva a uma imunossupressão sistêmica ao afetar pools de células imunológicas no fígado e no baço. Os mecanismos de sinalização aferente na periferia que levam ao desencadeamento do circuito reflexo colinérgico vagal imunossupressor são mal compreendidos. No entanto, 80 a 90% das fibras vagais são fibras sensoriais aferentes primárias e, portanto, os sinais das vísceras, muitos potencialmente impulsionados por células do sistema imunológico, podem levar à ativação de interneurônios no tronco encefálico e, por meio deles, a uma saída nas fibras vagais eferentes 46.
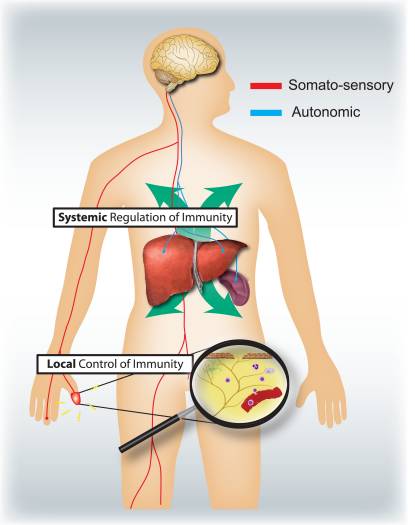
Figura 4: Os sistemas nervosos sensorial e autonômico modulam respostas imunes locais e sistêmicas, respectivamente. Nociceptores que inervam superfícies epiteliais (por exemplo, pele e pulmão) induzem respostas inflamatórias localizadas, ativando mastócitos e células dendríticas. Na inflamação alérgica das vias aéreas, na dermatite e na artrite reumatóide, os neurônios nociceptores desempenham um papel na condução da inflamação. Em contraste, os circuitos autonômicos que inervam os órgãos viscerais (por exemplo, baço e fígado) regulam as respostas imunes sistêmicas, bloqueando a ativação de macrófagos e células NKT. No acidente vascular cerebral e na endotoxemia séptica, esses neurônios desempenham um papel imunossupressor.
Normalmente, o curso do tempo e a natureza da inflamação, seja durante a infecção, reações alérgicas ou patologias auto-imunes, são definidos pelas categorias de células imunes envolvidas. Será importante saber quais tipos diferentes de células imunológicas são regulados por sinais sensoriais e autonômicos. Uma avaliação sistemática de quais mediadores podem ser liberados de nociceptores e neurônios autonômicos e a expressão de receptores para estes por diferentes células imunes inatas e adaptativas pode ajudar a resolver essa questão.
Durante a evolução, vias moleculares de detecção de perigo semelhantes foram desenvolvidas para imunidade inata e nocicepção, embora as células tenham linhagens de desenvolvimento completamente diferentes. Embora os PRRs e os canais de íons controlados por ligantes nocivos sejam estudados separadamente por imunologistas e neurobiologistas, a linha entre esses dois campos está cada vez mais tênue. Durante o dano tecidual e a infecção patogênica, a liberação de sinais de perigo pode levar a uma ativação coordenada de neurônios periféricos e células imunes com comunicação bidirecional complexa e uma defesa integrada do hospedeiro. O posicionamento anatômico dos nociceptores na interface com o ambiente, a velocidade da transdução neural e sua capacidade de liberar coquetéis potentes de mediadores de ação imunológica permitem que o sistema nervoso periférico module ativamente a resposta imune inata e coordene a imunidade adaptativa a jusante. Por outro lado, os nociceptores são altamente sensíveis aos mediadores imunológicos, que ativam e sensibilizam os neurônios. Inflamação neurogênica e imunomediada não são, portanto, entidades independentes, mas atuam juntas como dispositivos de alerta precoce. No entanto, o sistema nervoso periférico também desempenha um papel importante na fisiopatologia e talvez na etiologia de muitas doenças imunológicas como asma, psoríase ou colite, pois sua capacidade de ativar o sistema imunológico pode amplificar a inflamação patológica 15ological17. O tratamento para distúrbios imunológicos pode precisar incluir, portanto, o direcionamento de nociceptores, bem como de células imunológicas.
Agradecimentos
Agradecemos ao NIH pelo suporte (2R37NS039518).
Em conclusão,Compreender o papel da inflamação neurogênica quando se trata de defesa do hospedeiro e imunopatologia é essencial para determinar a abordagem de tratamento adequada para uma variedade de problemas de saúde do sistema nervoso. Ao observar as interações dos neurônios periféricos com as células do sistema imunológico, os profissionais de saúde podem avançar nas abordagens terapêuticas para ajudar a aumentar a defesa do hospedeiro, bem como suprimir a imunopatologia. O objetivo do artigo acima é ajudar os pacientes a compreender a neurofisiologia clínica da neuropatia, entre outros problemas de saúde de lesões nervosas. Informações referenciadas do National Center for Biotechnology Information (NCBI). O escopo de nossas informações é limitado à quiropraxia, bem como a lesões e condições da coluna vertebral. Para discutir o assunto, sinta-se à vontade para perguntar ao Dr. Jimenez ou entre em contato conosco em 915-850-0900 .
Curated pelo Dr. Alex Jimenez
Tópicos adicionais: Dor nas costas
Dor nas costas é uma das causas mais comuns de incapacidade e dias perdidos no trabalho em todo o mundo. De fato, a dor nas costas tem sido atribuída como a segunda razão mais comum para visitas a consultórios, superada apenas por infecções respiratórias superiores. Aproximadamente 80 por cento da população experimentará algum tipo de dor nas costas pelo menos uma vez ao longo da vida. A coluna é uma estrutura complexa composta de ossos, articulações, ligamentos e músculos, entre outros tecidos moles. Por causa disso, lesões e / ou condições agravadas, como hérnia de discos, pode eventualmente levar a sintomas de dor nas costas. Lesões esportivas ou acidentes automobilísticos geralmente são a causa mais frequente de dor nas costas, no entanto, às vezes, o mais simples dos movimentos pode ter resultados dolorosos. Felizmente, opções alternativas de tratamento, como quiropraxia, podem ajudar a aliviar a dor nas costas através do uso de ajustes espinhais e manipulações manuais, melhorando o alívio da dor.

TÓPICO EXTRA IMPORTANTE: Low Low Pain Management
MAIS TÓPICOS: EXTRA EXTRA: Dores e tratamentos crônicos
Blank
Referências
Acordeão próximo
Escopo de prática profissional *
As informações aqui contidas em "O Papel da Inflamação Neurogênica" não se destina a substituir um relacionamento individual com um profissional de saúde qualificado ou médico licenciado e não é um conselho médico. Incentivamos você a tomar decisões de saúde com base em sua pesquisa e parceria com um profissional de saúde qualificado.
Informações do blog e discussões de escopo
Nosso escopo de informações limita-se à Quiropraxia, musculoesquelética, medicamentos físicos, bem-estar, contribuindo distúrbios viscerossomáticos dentro de apresentações clínicas, dinâmica clínica de reflexo somatovisceral associada, complexos de subluxação, questões de saúde sensíveis e/ou artigos, tópicos e discussões de medicina funcional.
Nós fornecemos e apresentamos colaboração clínica com especialistas de várias disciplinas. Cada especialista é regido por seu escopo profissional de prática e sua jurisdição de licenciamento. Usamos protocolos funcionais de saúde e bem-estar para tratar e apoiar o cuidado de lesões ou distúrbios do sistema músculo-esquelético.
Nossos vídeos, postagens, tópicos, assuntos e insights abrangem assuntos clínicos, problemas e tópicos relacionados e apoiam direta ou indiretamente nosso escopo de prática clínica.*
Nosso escritório tentou razoavelmente fornecer citações de apoio e identificou o estudo de pesquisa relevante ou estudos que apóiam nossas postagens. Fornecemos cópias dos estudos de pesquisa de apoio à disposição dos conselhos regulatórios e do público mediante solicitação.
Entendemos que cobrimos questões que requerem uma explicação adicional de como isso pode ajudar em um plano de cuidados ou protocolo de tratamento específico; portanto, para discutir melhor o assunto acima, sinta-se à vontade para perguntar Dr. Alex Jiménez, DC, ou contacte-nos 915-850-0900.
Estamos aqui para ajudar você e sua família.
Bênçãos
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
o email: coach@elpasofunctionalmedicine. com
Licenciado como Doutor em Quiropraxia (DC) em Texas & Novo México*
Licença DC do Texas # TX5807, Novo México DC Licença # NM-DC2182
Licenciada como enfermeira registrada (RN*) in Florida
Licença da Flórida Licença RN # RN9617241 (Controle nº 3558029)
Status compacto: Licença Multiestadual: Autorizado para exercer em Estados 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Meu cartão de visita digital