Bioquímica da Dor: Todas as síndromes de dor têm um perfil de inflamação. Um perfil inflamatório pode variar de pessoa para pessoa e também pode variar em uma pessoa em momentos diferentes. O tratamento das síndromes dolorosas consiste em compreender este perfil de inflamação. As síndromes de dor são tratadas clinicamente, cirurgicamente ou ambos. O objetivo é inibir / suprimir a produção de mediadores inflamatórios. E um resultado bem-sucedido é aquele que resulta em menos inflamação e, claro, menos dor.
Conteúdo
Bioquímica Da Dor
Objetivos:
- Quem são os principais jogadores
- Quais são os mecanismos bioquímicos?
- Quais são as consequências?
Revisão de Inflamação:
Jogadores-chave
 Por que meu ombro dói? Uma revisão da base neuroanatômica e bioquímica da dor no ombro
Por que meu ombro dói? Uma revisão da base neuroanatômica e bioquímica da dor no ombro
RESUMO
Se um paciente perguntar “por que meu ombro dói?”, A conversa rapidamente se voltará para a teoria científica e, às vezes, para conjecturas infundadas. Freqüentemente, o clínico se torna ciente dos limites da base científica de sua explicação, demonstrando a incompletude de nossa compreensão da natureza da dor no ombro. Esta revisão faz uma abordagem sistemática para ajudar a responder a questões fundamentais relacionadas à dor no ombro, com o objetivo de fornecer insights sobre pesquisas futuras e novos métodos para o tratamento da dor no ombro. Devemos explorar os papéis de (1) os receptores periféricos, (2) processamento periférico da dor ou nocicepção , (3) a medula espinhal, (4) o cérebro, (5) a localização dos receptores no ombro e (6) ) a anatomia neural do ombro. Também consideramos como esses fatores podem contribuir para a variabilidade na apresentação clínica, o diagnóstico e o tratamento da dor no ombro. Desta forma, pretendemos fornecer uma visão geral das partes componentes do sistema de detecção periférica da dor e dos mecanismos centrais de processamento da dor no ombro que interagem para produzir dor clínica.
INTRODUÇÃO: UMA BREVE HISTÓRIA DA CIÊNCIA DA DOR ESSENCIAL PARA CLÍNICOS
A natureza da dor, em geral, tem sido um assunto de muita controvérsia no século passado. No século XVII, a teoria de Descartes17 propôs que a intensidade da dor estava diretamente relacionada à quantidade de lesão tecidual associada e que a dor era processada em uma via distinta. Muitas teorias anteriores baseavam-se na chamada filosofia descartiana dualista , vendo a dor como a consequência da estimulação de um receptor periférico específico de dor no cérebro. No século 1, uma batalha científica entre duas teorias opostas se seguiu, a saber, a teoria da especificidade e a teoria dos padrões. A "teoria da especificidade" Descartiana via a dor como uma modalidade específica separada de input sensorial com seu próprio aparato, enquanto a "teoria do padrão" considerava que a dor resultava da estimulação intensa de receptores não específicos.20 Em 2, Wall e Melzack's 1965 a teoria de gate da dor forneceu evidências para um modelo no qual a percepção da dor era modulada tanto pelo feedback sensorial quanto pelo sistema nervoso central. Outro grande avanço na teoria da dor mais ou menos na mesma época foi a descoberta do modo específico de ação dos opioides.3 Posteriormente, os avanços recentes na neuroimagem e na medicina molecular expandiram enormemente nossa compreensão geral da dor.
Então, como isso se relaciona com a dor no ombro? A dor no ombro é um problema clínico comum, e uma compreensão robusta da maneira como a dor é processada pelo corpo é essencial para diagnosticar e tratar melhor a dor de um paciente. Os avanços em nosso conhecimento sobre o processamento da dor prometem explicar a incompatibilidade entre a patologia e a percepção da dor; eles também podem nos ajudar a explicar por que certos pacientes não respondem a certos tratamentos.
BLOCOS DE CONSTRUÇÃO BÁSICOS DA DOR
Receptores sensoriais periféricos: o mecanorreceptor e o nociceptor
Existem vários tipos de receptores sensoriais periféricos presentes no sistema músculo-esquelético humano. 5 Eles podem ser classificados com base em sua função (como mecanorreceptores, termorreceptores ou nociceptores) ou morfologia (terminações nervosas livres ou diferentes tipos de receptores encapsulados) .5 Os diferentes tipos de receptor podem então ser subclassificados com base em a presença de certos marcadores químicos. Existem sobreposições significativas entre diferentes classes funcionais de receptor, por exemplo
Processamento de dor periférica: Nocicepção
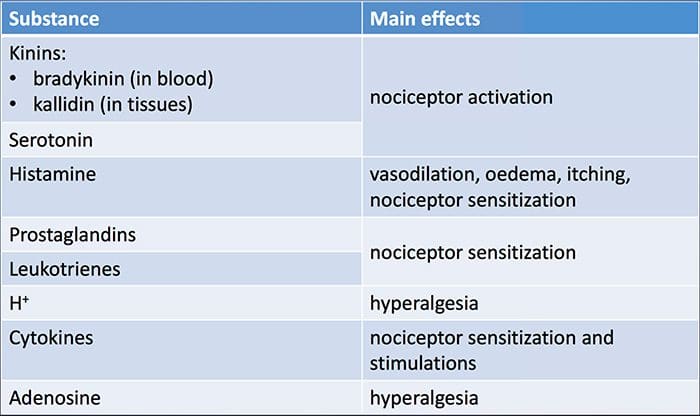
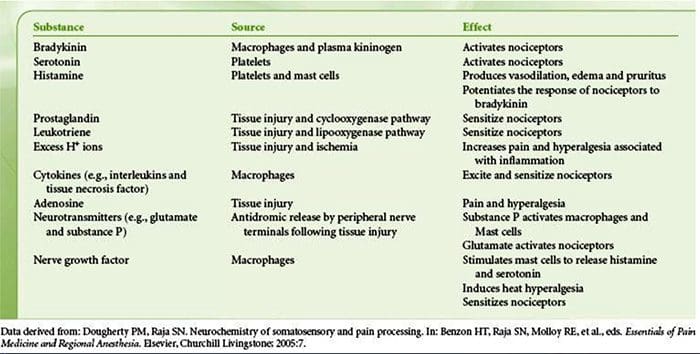
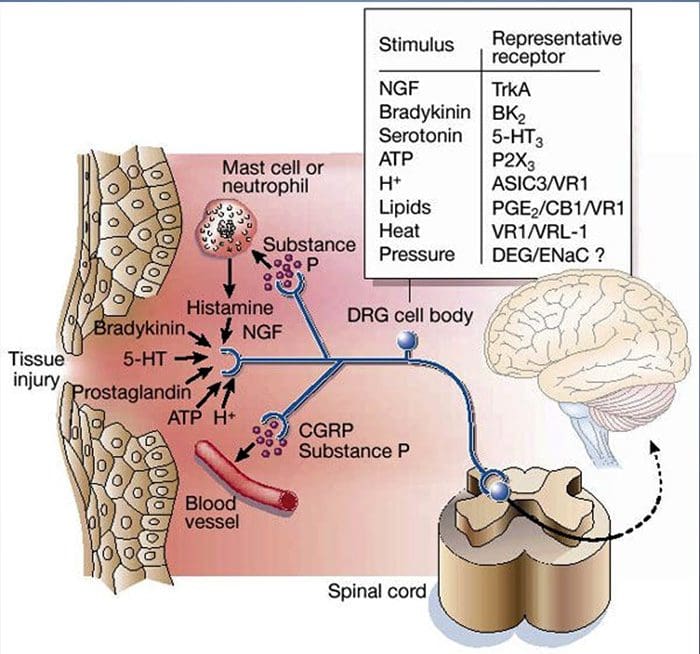
A lesão tecidual envolve uma variedade de mediadores inflamatórios liberados por células danificadas, incluindo bradicinina, histamina, 5-hidroxitriptamina, ATP, óxido nítrico e certos íons (K + e H +). A ativação da via do ácido araquidônico leva à produção de prostaglandinas, tromboxanos e leucotrienos. Citocinas, incluindo as interleucinas e o fator de necrose tumoral?, E neurotrofinas, como o fator de crescimento nervoso (NGF), também são liberadas e estão intimamente envolvidas na facilitação da inflamação.15 Outras substâncias, como aminoácidos excitatórios (glutamato) e opioides ( endotelina-1) também têm sido implicadas na resposta inflamatória aguda.16 17 Alguns desses agentes podem ativar diretamente os nociceptores, enquanto outros provocam o recrutamento de outras células que então liberam outros agentes facilitadores.18 Este processo local resulta no aumento da responsividade de neurônios nociceptivos para sua entrada normal e / ou o recrutamento de uma resposta para entradas normalmente subliminares é denominado "sensibilização periférica". A Figura 1 resume alguns dos principais mecanismos envolvidos.
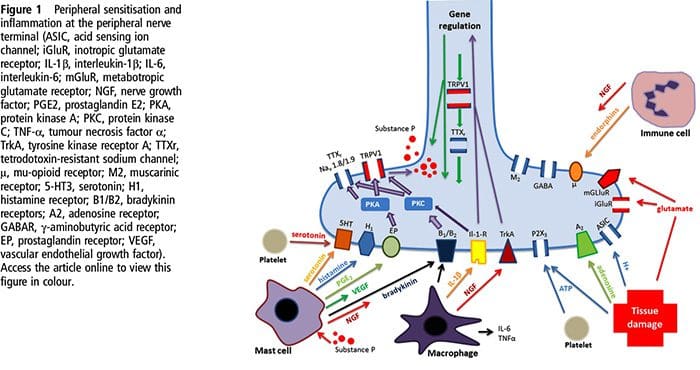 O NGF e o receptor do membro V da subfamília 1 do canal catiônico potencial do receptor transiente (TRPV1) têm uma relação simbiótica quando se trata de inflamação e sensibilização ao nociceptor. As citocinas produzidas no tecido inflamado resultam em um aumento na produção de NGF.19 O NGF estimula a liberação de histamina e serotonina (5-HT3) pelos mastócitos e também sensibiliza os nociceptores, possivelmente alterando as propriedades de A? fibras de forma que uma proporção maior se torna nociceptiva. O receptor TRPV1 está presente em uma subpopulação de fibras aferentes primárias e é ativado por capsaicina, calor e prótons. O receptor TRPV1 é sintetizado no corpo celular da fibra aferente e transportado para os terminais periférico e central, onde contribui para a sensibilidade dos aferentes nociceptivos. A inflamação resulta na produção de NGF perifericamente, que então se liga ao receptor de tirosina quinase tipo 1 nos terminais do nociceptor, o NGF é então transportado para o corpo da célula onde leva a uma regulação para cima da transcrição de TRPV1 e, consequentemente, aumento da sensibilidade do nociceptor.19 20 NGF e outros mediadores inflamatórios também sensibilizam o TRPV1 por meio de uma ampla gama de vias de mensageiros secundários. Muitos outros receptores, incluindo receptores colinérgicos, receptores de ácido <XNUMX> -aminobutírico (GABA) e receptores de somatostatina, também estão envolvidos na sensibilidade nociceptora periférica.
O NGF e o receptor do membro V da subfamília 1 do canal catiônico potencial do receptor transiente (TRPV1) têm uma relação simbiótica quando se trata de inflamação e sensibilização ao nociceptor. As citocinas produzidas no tecido inflamado resultam em um aumento na produção de NGF.19 O NGF estimula a liberação de histamina e serotonina (5-HT3) pelos mastócitos e também sensibiliza os nociceptores, possivelmente alterando as propriedades de A? fibras de forma que uma proporção maior se torna nociceptiva. O receptor TRPV1 está presente em uma subpopulação de fibras aferentes primárias e é ativado por capsaicina, calor e prótons. O receptor TRPV1 é sintetizado no corpo celular da fibra aferente e transportado para os terminais periférico e central, onde contribui para a sensibilidade dos aferentes nociceptivos. A inflamação resulta na produção de NGF perifericamente, que então se liga ao receptor de tirosina quinase tipo 1 nos terminais do nociceptor, o NGF é então transportado para o corpo da célula onde leva a uma regulação para cima da transcrição de TRPV1 e, consequentemente, aumento da sensibilidade do nociceptor.19 20 NGF e outros mediadores inflamatórios também sensibilizam o TRPV1 por meio de uma ampla gama de vias de mensageiros secundários. Muitos outros receptores, incluindo receptores colinérgicos, receptores de ácido <XNUMX> -aminobutírico (GABA) e receptores de somatostatina, também estão envolvidos na sensibilidade nociceptora periférica.
Um grande número de mediadores inflamatórios foi especificamente implicado na dor no ombro e na doença do manguito rotador.21 25 Embora alguns mediadores químicos ativem diretamente os nociceptores, a maioria leva a alterações no próprio neurônio sensorial em vez de ativá-lo diretamente. Essas mudanças podem ser dependentes da transcrição inicial ou tardia. Exemplos dos primeiros são as mudanças no receptor TRPV1 ou nos canais iônicos dependentes de voltagem resultantes da fosforilação de proteínas ligadas à membrana. Exemplos do último incluem o aumento induzido por NGF na produção do canal TRV1 e a ativação induzida por cálcio de fatores de transcrição intracelular.
Mecanismos Moleculares De Nocicepção
A sensação de dor nos alerta para lesões reais ou iminentes e desencadeia respostas protetoras adequadas. Infelizmente, a dor muitas vezes sobrevive à sua utilidade como sistema de alerta e, em vez disso, torna-se crônica e debilitante. Essa transição para uma fase crônica envolve mudanças na medula espinhal e no cérebro, mas também há uma modulação notável onde as mensagens de dor são iniciadas - no nível do neurônio sensorial primário. Os esforços para determinar como esses neurônios detectam estímulos produtores de dor de natureza térmica, mecânica ou química revelaram novos mecanismos de sinalização e nos aproximaram da compreensão dos eventos moleculares que facilitam a transição da dor aguda para a persistente.
 A Neuroquímica Dos Nociceptores
A Neuroquímica Dos Nociceptores
O glutamato é o neurotransmissor excitatório predominante em todos os nociceptores. Estudos histoquímicos de DRG adultos, no entanto, revelam duas classes amplas de fibra C não mielinizada.
Transdutores químicos para piorar a dor
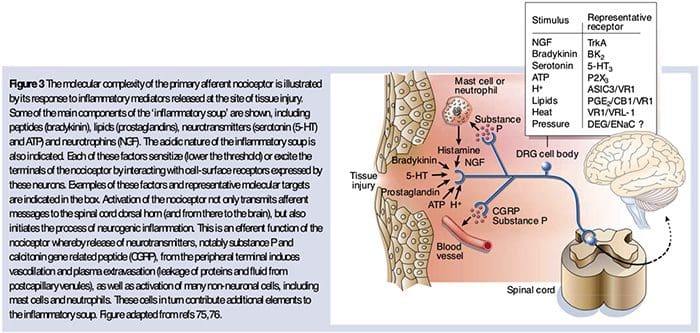
Como descrito acima, a lesão aumenta nossa experiência de dor aumentando a sensibilidade dos nociceptores a estímulos térmicos e mecânicos. Este fenômeno resulta, em parte, da produção e liberação de mediadores químicos do terminal sensorial primário e de células não neurais (por exemplo, fibroblastos, mastócitos, neutrófilos e plaquetas) no ambiente 36 (Fig. 3). Alguns componentes da sopa inflamatória (por exemplo, prótons, ATP, serotonina ou lipídios) podem alterar diretamente a excitabilidade neuronal pela interação com canais iônicos na superfície do nociceptor, enquanto outros (por exemplo, bradicinina e NGF) se ligam a receptores metabotrópicos e mediar seus efeitos através de cascatas de sinalização de segundo mensageiro 11. Um progresso considerável foi alcançado na compreensão da base bioquímica de tais mecanismos modulatórios.
Prótons extracelulares e acidose tecidual
A acidose tecidual local é uma resposta fisiológica marcante à lesão, e o grau de dor ou desconforto associados está bem correlacionado com a magnitude da acidificação37. A aplicação de ácido (pH 5) à pele produz descargas sustentadas em um terço ou mais de nociceptores polimodais que inervam o campo receptivo 20.
 Mecanismos celulares e moleculares da dor
Mecanismos celulares e moleculares da dor
Sumário
O sistema nervoso detecta e interpreta uma ampla gama de estímulos térmicos e mecânicos, bem como irritantes químicos ambientais e endógenos. Quando intensos, esses estímulos geram dor aguda e, no quadro de lesão persistente, os componentes do sistema nervoso periférico e central da via de transmissão da dor exibem tremenda plasticidade, aumentando os sinais de dor e produzindo hipersensibilidade. Quando a plasticidade facilita os reflexos de proteção, pode ser benéfica, mas quando as mudanças persistem, pode ocorrer uma condição de dor crônica. Estudos genéticos, eletrofisiológicos e farmacológicos estão elucidando os mecanismos moleculares subjacentes à detecção, codificação e modulação de estímulos nocivos que geram dor.
Introdução: Dor Aguda versus Dor Persistente
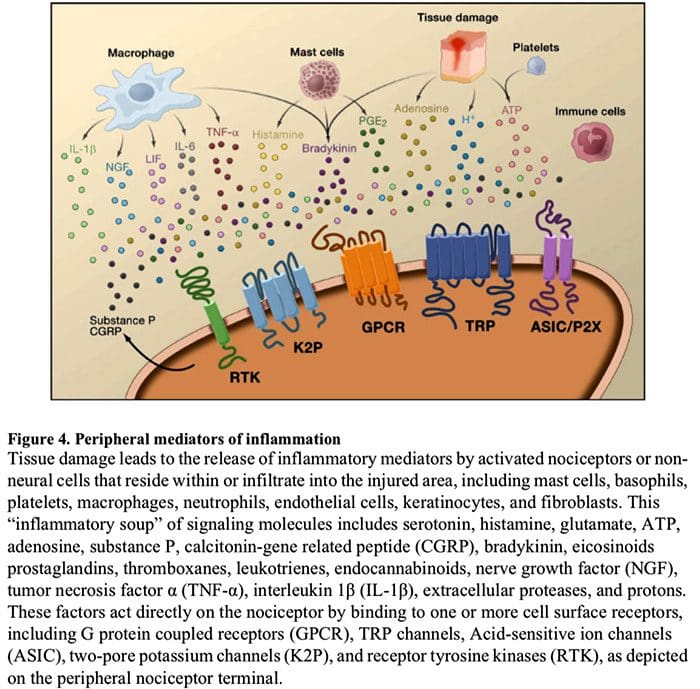
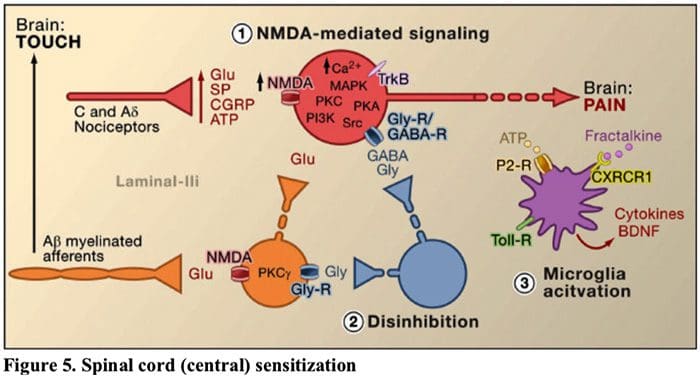 Figura 5. Sensibilização da Medula Espinhal (Central)
Figura 5. Sensibilização da Medula Espinhal (Central)
- Sensibilização mediada por receptor de glutamato / NMDA. Seguindo estimulação intensa ou lesão persistente, ativou C e A? os nociceptores liberam uma variedade de neurotransmissores, incluindo dlutamato, substância P, peptídeo relacionado ao gene da calcitonina (CGRP) e ATP, em neurônios de saída na lâmina I do corno dorsal superficial (vermelho). Como consequência, os receptores de glutamato NMDA normalmente silenciosos localizados no neurônio pós-sináptico podem agora sinalizar, aumentar o cálcio intracelular e ativar uma série de vias de sinalização dependentes de cálcio e segundos mensageiros, incluindo proteína quinase ativada por mitogênio (MAPK), proteína quinase C (PKC) , proteína quinase A (PKA) e Src. Essa cascata de eventos aumentará a excitabilidade do neurônio de saída e facilitará a transmissão de mensagens de dor ao cérebro.
- Desinibição. Em circunstâncias normais, os interneurônios inibitórios (azul) liberam continuamente GABA e / ou glicina (Gly) para diminuir a excitabilidade dos neurônios de saída da lâmina I e modular a transmissão da dor (tom inibitório). No entanto, no cenário de lesão, essa inibição pode ser perdida, resultando em hiperalgesia. Além disso, a desinibição pode permitir o A? Mielinizado não nociceptivo. os aferentes primários para envolver o circuito de transmissão da dor de modo que estímulos normalmente inócuos sejam agora percebidos como dolorosos. Isso ocorre, em parte, por meio da desinibição da PKC? expressando interneurônios na lâmina interna II.
- Ativação Microglial. A lesão do nervo periférico promove a liberação de ATP e da quimiocina fractalcina que estimulará as células microgliais. Em particular, a ativação de receptores purinérgicos, CX3CR1 e semelhantes a Toll na microglia (roxo) resulta na liberação de fator neurotrófico derivado do cérebro (BDNF), que através da ativação de receptores TrkB expressos por neurônios de saída da lâmina I, promove aumento da excitabilidade e dor aumentada em resposta à estimulação nociva e inócua (ou seja, hiperalgesia e alodinia). A microglia ativada também libera uma série de citocinas, como o fator de necrose tumoral? (TNF?), Interleucina-1? e 6 (IL-1 ?, IL-6) e outros fatores que contribuem para a sensibilização central.
O ambiente químico da inflamação
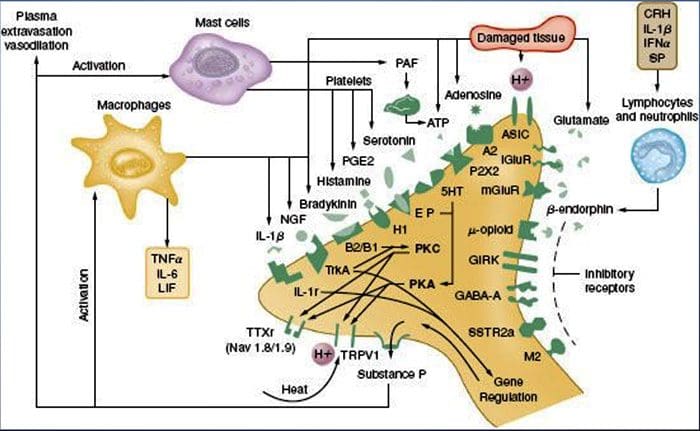
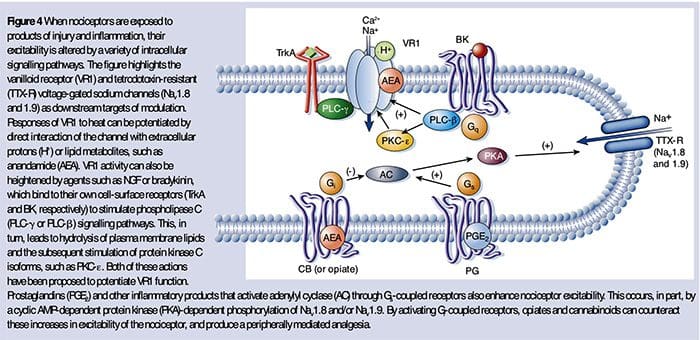
A sensibilização periférica resulta mais comumente de mudanças associadas à inflamação no ambiente químico da fibra nervosa (McMahon et al., 2008). Assim, o dano tecidual é frequentemente acompanhado pelo acúmulo de fatores endógenos liberados de nociceptores ativados ou células não neurais que residem ou se infiltram na área lesada (incluindo mastócitos, basófilos, plaquetas, macrófagos, neutrófilos, células endoteliais, queratinócitos e fibroblastos). Coletivamente. esses fatores, denominados "sopa inflamatória", representam uma ampla gama de moléculas de sinalização, incluindo neurotransmissores, peptídeos (substância P, CGRP, bradicinina), eicosinóides e lipídeos relacionados (prostaglandinas, tromboxanos, leucotrienos, endocanabinóides), neurotrofinas, citocinas e quimiocinas, bem como proteases e prótons extracelulares. Notavelmente, os nociceptores expressam um ou mais receptores de superfície celular capazes de reconhecer e responder a cada um desses agentes pró-inflamatórios ou pró-algésicos (Figura 4). Essas interações aumentam a excitabilidade da fibra nervosa, aumentando assim sua sensibilidade à temperatura ou ao toque.
Inquestionavelmente, a abordagem mais comum para reduzir a dor inflamatória envolve inibir a síntese ou o acúmulo de componentes da sopa inflamatória. Isto é melhor exemplificado por fármacos anti-inflamatórios não esteróides, tais como aspirina ou ibuprofeno, que reduzem a dor inflamatória e a hiperalgesia pela inibição das ciclooxigenases (Cox-1 e Cox-2) envolvidas na síntese das prostaglandinas. Uma segunda abordagem é bloquear as ações dos agentes inflamatórios no nociceptor. Aqui, destacamos exemplos que fornecem uma nova visão sobre os mecanismos celulares de sensibilização periférica, ou que formam a base de novas estratégias terapêuticas para o tratamento da dor inflamatória.
O NGF é talvez mais conhecido por seu papel como um fator neurotrófico necessário para a sobrevivência e desenvolvimento de neurônios sensoriais durante a embriogênese, mas no adulto, o NGF também é produzido no contexto de lesão tecidual e constitui um componente importante da sopa inflamatória (Ritner et al. al., 2009). Entre seus muitos alvos celulares, o NGF age diretamente sobre os nociceptores da fibra C peptidérgicos, que expressam a tirosina quinase do receptor de NGF de alta afinidade, TrkA, bem como o receptor de neurotrofina de baixa afinidade, p75 (Chao, 2003; Snider e McMahon, 1998). O NGF produz uma profunda hipersensibilidade ao calor e estímulos mecânicos através de dois mecanismos temporalmente distintos. Inicialmente, uma interação NGF-TrkA ativa as vias de sinalização a jusante, incluindo a fosfolipase C (PLC), proteína quinase ativada por mitógeno (MAPK) e fosfoinositídeo 3-quinase (PI3K). Isto resulta na potenciação funcional de proteínas alvo no terminal nociceptor periférico, mais notavelmente o TRPV1, levando a uma rápida mudança na sensibilidade ao calor celular e comportamental (Chuang et al., 2001).
Independentemente de seus mecanismos pró-nociceptivos, interferir na sinalização de neurotrofinas ou citocinas tornou-se uma estratégia importante para controlar a doença inflamatória ou a dor resultante. A abordagem principal envolve o bloqueio de NGF ou TNF-? ação com um anticorpo neutralizante. No caso do TNF- ?, isso tem sido notavelmente eficaz no tratamento de várias doenças autoimunes, incluindo artrite reumatóide, levando a uma redução dramática na destruição do tecido e hiperalgesia associada (Atzeni et al., 2005). Como as principais ações do NGF no nociceptor adulto ocorrem no cenário de inflamação, a vantagem dessa abordagem é que a hiperalgesia diminuirá sem afetar percepção de dor normal. De fato, os anticorpos anti-NGF estão atualmente em testes clínicos para o tratamento de síndromes de dor inflamatória (Hefti et al., 2006).
Sensibilização mediada por receptor de glutamato / NMDA
A dor aguda é sinalizada pela liberação de glutamato dos terminais centrais dos nociceptores, gerando correntes pós-sinápticas excitatórias (EPSCs) nos neurônios do corno dorsal de segunda ordem. Isso ocorre principalmente através da ativação dos subtipos pós-sinápticos de AMPA e cainato dos receptores de glutamato ionotrópico. A soma dos EPSCs sub-limiares no neurônio pós-sináptico acabará resultando em disparo de potencial de ação e transmissão da mensagem de dor para neurônios de ordem superior.
Outros estudos indicam que mudanças no próprio neurônio de projeção contribuem para o processo desinibitório. Por exemplo, a lesão do nervo periférico regula negativamente profundamente o co- transportador de K + - Cl- KCC2, que é essencial para manter os gradientes normais de K + e Cl- através da membrana plasmática (Coull et al., 2003). A regulação negativa de KCC2, que é expressa em neurônios de projeção da lâmina I, resulta em um desvio no gradiente de Cl, de modo que a ativação dos receptores GABA-A despolariza, em vez de hiperpolarizar os neurônios de projeção da lâmina I. Isso, por sua vez, aumentaria a excitabilidade e aumentaria a transmissão da dor. De facto, o bloqueio farmacológico ou a regulação negativa mediada por siARN de KCC2 no rato induz alodinia mecânica.
Fontes:
Por que meu ombro está doendo? Uma revisão da base neuroanatômica e bioquímica da dor no ombro
Benjamin John Floyd Dean, Stephen Edward Gwilym, Andrew Jonathan Carr
Mecanismos celulares e moleculares da dor
Allan I. Basbaum1, Diana M. Bautista2, Gre? Gory Scherrer1 e David Julius3
1Departamento de Anatomia, Universidade da Califórnia, San Francisco 94158
2Departamento de Biologia Molecular e Celular, Universidade da Califórnia, Berkeley CA 94720 3Departamento de Fisiologia, Universidade da Califórnia, São Francisco 94158
Mecanismos moleculares de nocicepção
David Julius * e Allan I. Basbaum
*Departamento de Farmacologia Celular e Molecular e �Departamentos de Anatomia e Fisiologia e WM Keck Foundation Center for Integrative Neuroscience, University of California San Francisco, San Francisco, California 94143, USA (e-mail: julius@sócrates.ucsf.edu)
Escopo de prática profissional *
As informações aqui contidas em "Bioquímica Da Dor" não se destina a substituir um relacionamento individual com um profissional de saúde qualificado ou médico licenciado e não é um conselho médico. Incentivamos você a tomar decisões de saúde com base em sua pesquisa e parceria com um profissional de saúde qualificado.
Informações do blog e discussões de escopo
Nosso escopo de informações limita-se à Quiropraxia, musculoesquelética, medicamentos físicos, bem-estar, contribuindo distúrbios viscerossomáticos dentro de apresentações clínicas, dinâmica clínica de reflexo somatovisceral associada, complexos de subluxação, questões de saúde sensíveis e/ou artigos, tópicos e discussões de medicina funcional.
Nós fornecemos e apresentamos colaboração clínica com especialistas de várias disciplinas. Cada especialista é regido por seu escopo profissional de prática e sua jurisdição de licenciamento. Usamos protocolos funcionais de saúde e bem-estar para tratar e apoiar o cuidado de lesões ou distúrbios do sistema músculo-esquelético.
Nossos vídeos, postagens, tópicos, assuntos e insights abrangem assuntos clínicos, problemas e tópicos relacionados e apoiam direta ou indiretamente nosso escopo de prática clínica.*
Nosso escritório tentou razoavelmente fornecer citações de apoio e identificou o estudo de pesquisa relevante ou estudos que apóiam nossas postagens. Fornecemos cópias dos estudos de pesquisa de apoio à disposição dos conselhos regulatórios e do público mediante solicitação.
Entendemos que cobrimos questões que requerem uma explicação adicional de como isso pode ajudar em um plano de cuidados ou protocolo de tratamento específico; portanto, para discutir melhor o assunto acima, sinta-se à vontade para perguntar Dr. Alex Jiménez, DC, ou contacte-nos 915-850-0900.
Estamos aqui para ajudar você e sua família.
Bênçãos
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
o email: coach@elpasofunctionalmedicine. com
Licenciado como Doutor em Quiropraxia (DC) em Texas & Novo México*
Licença DC do Texas # TX5807, Novo México DC Licença # NM-DC2182
Licenciada como enfermeira registrada (RN*) in Florida
Licença da Flórida Licença RN # RN9617241 (Controle nº 3558029)
Status compacto: Licença Multiestadual: Autorizado para exercer em Estados 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Meu cartão de visita digital







