Após a transecção do nervo periférico do membro superior e o reparo cirúrgico, alguns pacientes recuperam a boa função sensório-motora, enquanto outros não. A compreensão dos mecanismos periféricos e centrais que contribuem para a recuperação pode facilitar o desenvolvimento de novas intervenções terapêuticas. A plasticidade após a transecção do nervo periférico foi demonstrada em todo o neuroeixo em modelos animais de lesão do nervo. No entanto, as alterações cerebrais que ocorrem após a transecção do nervo periférico e reparo cirúrgico em humanos não foram examinadas. Além disso, a extensão em que a regeneração do nervo periférico influencia as alterações funcionais e estruturais do cérebro não foi caracterizada. Portanto, questionamos se as mudanças funcionais são acompanhadas por mudanças estruturais na substância cinzenta e / ou branca e se essas mudanças estão relacionadas à recuperação sensorial? Para abordar essas questões principais, (i) avaliamos a regeneração dos nervos periféricos; (ii) medição da ativação cerebral por imagem de ressonância magnética funcional (sinal dependente do nível de oxigênio no sangue; BOLD) em resposta a um estímulo vibrotátil; (iii) examinou a plasticidade cerebral estrutural da substância cinzenta e branca; e (iv) medidas de recuperação sensorial correlacionadas com alterações da massa cinzenta em transecção de nervo periférico e pacientes de reparo cirúrgico. Em comparação com o nervo contralesional saudável de cada paciente, os nervos seccionados têm condução nervosa prejudicada 1.5 anos após a transecção e reparo, conduzindo com amplitude diminuída e latência aumentada. Em comparação com controles saudáveis, a transecção do nervo periférico e os pacientes de reparo cirúrgico tinham atividade de sinal dependente do nível de oxigênio no sangue alterada nos córtices somatosensoriais primários e secundários contralesionais e em um conjunto de áreas cerebrais conhecidas como rede positiva de tarefa . Além disso, as reduções de massa cinzenta foram identificadas em várias áreas do cérebro, incluindo os córtices somatosensoriais primários e secundários contralesionais, nas mesmas áreas onde as reduções de sinal dependentes do nível de oxigênio no sangue foram identificadas. Além disso, o afinamento da massa cinzenta no giro pós-central foi negativamente correlacionado com as medidas de recuperação sensorial (detecção mecânica e de vibração), demonstrando uma ligação clara entre função e estrutura. Finalmente, identificamos redução da anisotropia fracionada da substância branca na ínsula direita em uma região que também apresentava redução da substância cinzenta. Esses resultados fornecem informações sobre a plasticidade do cérebro e as relações estrutura-função-comportamento após lesão do nervo e têm importantes implicações terapêuticas.
Palavras-chave: espessura cortical; fMRI; imagem por tensor de difusão; plasticidade; lesão do nervo periférico
Abreviaturas: BA = área de Brodmann; NEGRITO = dependente do nível de oxigênio no sangue; fMRI = ressonância magnética funcional;
PNIr = transecção do nervo periférico e reparo cirúrgico; S1 = córtex somatossensorial primário; S2 = córtex somatossensorial secundário
Conteúdo
Introdução
Após a transecção do nervo periférico do membro superior e reparo cirúrgico (PNIr), cerca de 25% dos pacientes não voltaram ao trabalho 1.5 anos após a cirurgia (Jaquet et al., 2001). Além disso, cerca de 57% dos pacientes com lesões nervosas têm entre 16 e 35 anos de idade (McAllister et al., 1996); assim, uma longa vida de incapacidade e dificuldades econômicas pode acompanhar a transecção do nervo do membro superior. Compreender as ramificações centrais e periféricas da lesão de nervo periférico pode facilitar o desenvolvimento de novas estratégias terapêuticas e programas de intervenção.
Não se sabe como o cérebro responde ao PNIr em humanos. No entanto, estudos em animais estabeleceram que a plasticidade dentro do córtex somatossensorial começa imediatamente após a transecção do nervo periférico, e que 1 ano após a transecção completa do nervo e reparo cirúrgico, os mapas corticais contêm representações não contínuas dos nervos transectados e adjacentes (Wall et al ., 1986). Acredita-se que os mecanismos que facilitam a plasticidade funcional incluem o desmascaramento imediato de projeções preexistentes dos níveis corticais e subcorticais adjacentes e o surgimento de axônios a longo prazo em múltiplos níveis do neuroeixo, incluindo o córtex somatossensorial primário (S1) (Florence and Kaas , 1995; Hickmott e Steen, 2005).
Estudos de imagem do cérebro humano corroboram os achados de modelos animais com a identificação de mapas alterados de ativação funcional da RM devido a lesão da medula espinhal, amputação, transferência de um polegar para o outro e em pacientes com síndrome do túnel do carpelo (Lotze et al., 2001; Manduch e outros, 2002; Jurkiewicz e outros, 2006; Napadow e outros, 2006). Além disso, estudos de RM estrutural têm visualizado recentemente as alterações da substância cinzenta e branca após lesões traumáticas e em diversas condições patológicas, incluindo amputação de membros e dor crônica (Apkarian et al., 2004; Draganski et al., 2006; Davis et al., 2008; Geha et al., 2008; May, 2008). Pensa-se que as alterações na matéria cinzenta estão relacionadas com alterações no tamanho das células, atrofia e / ou perda de neurónios ou glia, enquanto as alterações da substância branca são afectadas pela degeneração axonal e perda de mielina (Beaulieu, 2002; May, 2008).
Uma abordagem poderosa para delinear mecanismos de patologia e plasticidade é combinar técnicas funcionais e estruturais de imagem de substância cinzenta e branca. Relatamos anteriormente que pacientes com PNIr completo no membro superior mantiveram déficits somatossensitivos profundos que persistem 41.5 anos após a cirurgia (Taylor et al., 2008a). Com base nesses achados, raciocinamos que esses pacientes apresentariam alterações cerebrais funcionais e estruturais nas principais áreas cerebrais somatossensoriais. Portanto, neste estudo, hipotetizamos que os pacientes com PNIr teriam: (i) respostas reduzidas do nível de oxigênio no sangue (BOLD) à estimulação vibratória do território do nervo transeccionado, na região do S1 que representa o membro superior lesionado e no secundário. córtex somatossensorial (S2); (ii) uma redução correspondente na espessura cortical nestas regiões do contralateral S1 e S2; (iii) uma correlação entre mudanças na espessura cortical e medidas psicofísicas da função somatossensorial (limiares de detecção de vibração e toque); e (iv) redução da anisotropia fracionada (uma medida da integridade da substância branca) na matéria branca que entra e sai dessas áreas corticais somatossensoriais.
De Depósito
Assuntos
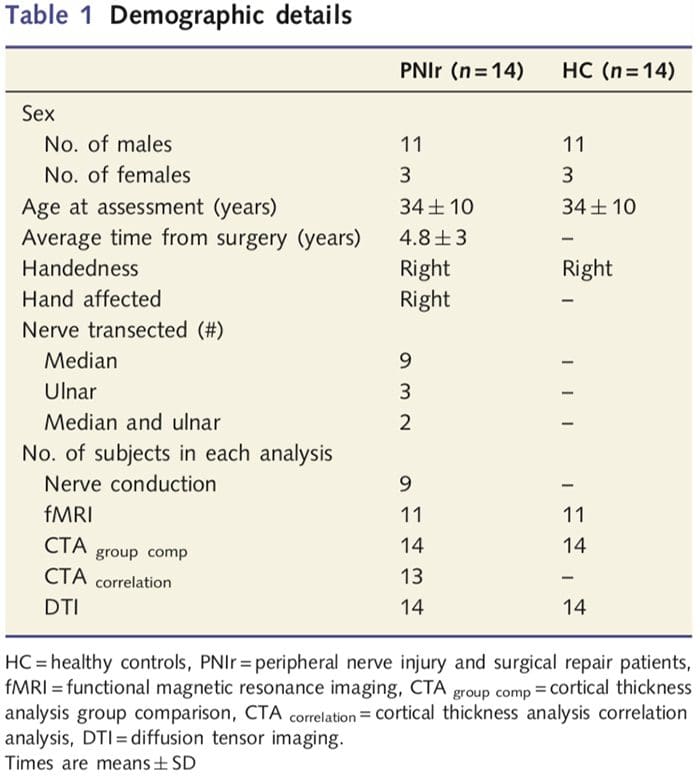
Recrutamos 27 pacientes com transecção completa do nervo mediano e / ou ulnar seguido por reparo cirúrgico de cirurgiões plásticos afiliados ao Programa de Mão da Universidade de Toronto entre junho de 2006 e maio de 2008. Desta coorte maior, 14 pacientes sem dor (três mulheres , 11 homens; 34–10 anos) com transecção completa do nervo mediano e / ou ulnar direito foram incluídos no estudo [para evitar confusos relacionados à presença de dor e lateralidade em pacientes com dor (n = 6) e lesões do lado esquerdo (n = 7) foram excluídos desta análise]. Todos os pacientes foram submetidos a reparo de nervo microcirúrgico pelo menos 1.5 anos antes da inscrição no estudo (o tempo de recuperação variou de 1.5 a 8 anos). Além disso, recrutamos 14 controles saudáveis pareados por idade e sexo (3 mulheres, 11 homens; 34–10 anos). Todos os sujeitos deram consentimento informado por escrito para os procedimentos aprovados pelo Conselho de Ética em Pesquisa da University Health Network. Todos os indivíduos eram destros (determinado usando o inventário de lateralidade de Edimburgo: Oldfield, 1971) e não tinham histórico de lesão neurológica ou dor crônica (antes ou depois da transecção do nervo). Consulte a Tabela 1 para obter detalhes demográficos.
Design de estudo
Todos os indivíduos participaram de uma sessão de imagens que incluiu: (i) ressonância magnética funcional (fMRI) em resposta a estímulos vibrotáteis aplicados no dedo indicador direito (dentro do território do nervo mediano); (ii) uma varredura anatômica de alta resolução de todo o cérebro, adquirida para registro de imagens e para a análise da massa cinzenta cortical; e (iii) dois escaneamentos por tensor de difusão para avaliação da integridade da substância branca. Antes da aquisição de imagens, os participantes foram instruídos no projeto básico do experimento e lembraram de permanecer o mais imóvel possível durante a duração da varredura.
Os indivíduos estavam livres para se retirar do estudo a qualquer momento. Além disso, uma avaliação sensorial e motora foi realizada para todos os sujeitos (Taylor et al., 2008a). Como os limiares de detecção de toque e vibração foram correlacionados com a espessura cortical, uma descrição desses métodos é incluída abaixo (outras medidas psicofísicas serão relatadas em outros lugares).
Limiar de vibração
Os limiares de detecção de vibração foram determinados usando um Bio-Thesiometer portátil (Bio-Medical Instrument Company, EUA). O dispositivo tem uma sonda 12-mm que foi colocada na falange distal do dedo indicador direito (D2). Os limiares foram determinados pelo método dos limites: a amplitude (voltagem) foi gradualmente aumentada até o sujeito indicar que percebia o estímulo. Os limiares de vibração foram adquiridos três vezes e um valor médio foi calculado. Durante o teste do limiar de vibração, os participantes foram instruídos a fechar os olhos e apoiar as costas da mão em uma almofada de apoio.
Limite de Detecção Mecânica
Limiares de detecção mecânica foram determinados usando um conjunto padronizado de filamentos de von Frey (OptiHair2 Marstock Nervtest, Alemanha) contendo 12 filamentos calibrados espaçados logaritmicamente que entregaram forças de 0.25 ± 512 mN. O diâmetro da superfície de contato de todos os 12 filamentos era de ~ 0.4 mm. Os ensaios foram conduzidos com os olhos dos sujeitos fechados e as mãos apoiadas em uma almofada macia. As sondas foram aplicadas em uma série ascendente e os sujeitos foram solicitados a dar uma resposta toda vez que sentissem uma sonda tocar a ponta do dedo D2 direito. Este processo foi repetido três vezes. A força para o filamento que foi detectada em pelo menos dois dos três ensaios foi relatada como o limite de detecção mecânica daquele sujeito.
Teste de condução nervosa
Os pacientes participaram de estudos bilaterais de condução nervosa sensorial e motora na clínica de eletromiografia (EMG) do Toronto Western Hospital. Para a condução do nervo motor, o eletrodo estimulador foi colocado no punho e cotovelo (separadamente) e o eletrodo de registro foi colocado sobre o abdutor curto do polegar, para avaliação do nervo mediano, ou o abdutor do dedo mínimo para avaliação do nervo ulnar. Para o teste do nervo sensorial, o eletrodo de registro foi colocado no pulso e o eletrodo estimulador foi colocado nos dígitos D2, D3 e D5. Um neurologista sênior experiente da Clínica EMG do Toronto Western Hospital (Dr. Peter Ashby) revisou todas as avaliações clínicas para determinar quais nervos demonstraram respostas normais / anormais. Como as medidas de amplitude e latência são conhecidas por variarem substancialmente entre os sujeitos (devido a fatores como a densidade da inervação, a profundidade do nervo e a espessura da pele de um sujeito individual) (Kimura, 2001), o nervo não transfectado de cada paciente serviu como seu próprio controle para comparação com os valores do lado seccionado. Naqueles pacientes com respostas de condução nervosa detectáveis, testes t pareados foram realizados para avaliar a diferença nas medidas de latência ou amplitude entre os nervos transectados e contralesionais não transectados de cada paciente.
Parâmetros de imagem
Os dados de imagem do cérebro foram adquiridos usando um sistema 3T GE MRI equipado com uma bobina de cabeça phased array de oito canais. Os indivíduos foram colocados em decúbito dorsal na mesa de ressonância magnética e a cabeça de cada um deles foi acolchoada para reduzir o movimento. Dados de fMRI de todo o cérebro foram adquiridos usando imagens de eco planar (28 cortes axiais, campo de visão (FOV) = 20 x 20 cm, matriz de 64 x 64, voxels de 3.125 x 3.125 x 4 mm, tempo de eco (TE) = 30 ms, repetição tempo (TR) = 2000 ms). O tempo de varredura foi de 5 min e 8 s (154 quadros). Durante a varredura, um estímulo vibrotátil não doloroso de 12 Hz foi aplicado à falange distal do D2 direito usando diafragma de balão acionado por ar comprimido (dispositivo fabricado pelo Dr. Christo Pantev; www.biomag.uni-muenster.de). Os estímulos foram entregues em blocos de 10s intercalados com 20s de descanso, totalizando 10 blocos de estimulação e 10 blocos de descanso. Os primeiros 8 s (4 TRs) de dados adquiridos de cada execução foram descartados para permitir o equilíbrio do sinal de fMRI. Os indivíduos foram instruídos a manter os olhos fechados durante a varredura e focar nos estímulos. Uma varredura anatômica tridimensional (3D) de alta resolução de todo o cérebro (124 cortes sagitais, 24 x 24 cm FOV, matriz 256 x 256, 1.5 x 0.94 x 0.94 mm voxels) foi adquirida com uma sequência de gradiente eco estragada em 1D ponderada em T3 (média de um sinal, ângulo de inversão = 20?, TE? 5 ms). Além disso, duas varreduras de imagens de tensor de difusão (38 cortes axiais, FOV 24 x 24 cm, matriz de 128 x 128, voxels de 1.875 x 1.875 x 3 mm) foram adquiridas ao longo de 23 direções com um valor b de 1000smm 2. Cada execução também continha dois volumes sem ponderação de difusão.
Análise fMRI
Os dados foram analisados usando Brainvoyager QX v1.8 (Brain Innovaton, Maastricht, Holanda). O pré-processamento incluiu: correção de movimento 3D, correção de tempo de varredura de fatia, remoção de tendência linear, filtragem passa alta (cinco ciclos por corrida) e suavização espacial com um kernel Gaussiano de largura total 6mm na metade máxima (FWHM). Os conjuntos de dados fMRI foram interpolados para voxels 3 x 3 x 3 mm, registrados na imagem anatômica de alta resolução, e normalizados para o espaço Talairach padrão (Talairach e Tournoux, 1988). Os voxels são relatados como 1 x 1 x 1 mm. Os dados foram analisados utilizando o modelo linear geral; o modelo foi obtido por convolução da função de vagão do curso temporal da estimulação tátil com a função de resposta hemodinâmica padrão. Para identificar diferenças entre os grupos nos padrões de ativação, uma análise de efeitos fixos foi realizada com os contrastes: (i) controles saudáveis: estimulação 4 repouso; (ii) PNIr: estimulação 4 rest; e (iii) controles saudáveis 4 PNIr. Os mapas de ativação foram limitados a um valor corrigido de P50.05 (derivado de voxels contíguos P50.0001 e 120mm3 não corrigidos, conforme relatado anteriormente: Taylor e Davis, 2009); isso também foi validado com a execução de uma Simulação de Monte Carlo com o aplicativo AlphaSim implementado no software Análise de Neuroimagem Funcional (AFNI). Esta análise incluiu apenas os doentes 11 que sofreram transecção do nervo mediano direito (n = 9) ou a mediana direita e nervo ulnar (n = 2) (ou seja, os três pacientes com transecção do nervo ulnar direito puro não foram incluídos nesta análise ).
Análise de Espessura Cortical
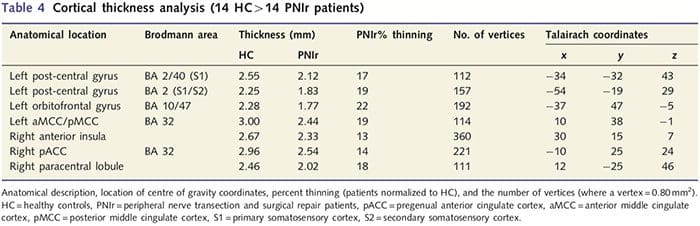
A análise da espessura cortical foi realizada com Freesurfer (http: // surfer.nmr.mgh.harvard.edu); os métodos foram descritos em detalhes em outro lugar (Dale et al., 1999; Fischl et al., 1999a, b; Fischl e Dale 2000). Resumidamente, conjuntos de dados anatômicos ponderados em T1 de alta resolução foram registrados no atlas de Talairach (Talairach e Tournoux, 1988). Seguiu-se a normalização da intensidade, remoção do crânio e separação dos hemisférios. Posteriormente, os limites da substância branca / cinzenta (denominada superfície branca) e cinza / CSF (denominada superfície pial) foram identificados e segmentados. A distância entre as superfícies branca e pial foi então calculada em cada ponto em cada hemisfério do cérebro. Para identificar diferenças de grupo entre os 14 pacientes e 14 controles pareados por idade / sexo, uma análise de modelo linear geral foi realizada em cada ponto do cérebro. Como a topografia cortical do indivíduo é inerentemente heterogênea, um kernel de suavização espacial FWHM de 5 mm foi aplicado antes da análise estatística. Os dados são exibidos em um P50.05 corrigido (derivado de um P50.0075 não corrigido e 102 vértices contíguos); isso foi calculado executando uma simulação de Monte Carlo com AlphaSim. Um vértice representa um ponto em uma folha bidimensional e, neste estudo, a distância entre dois vértices é de 0.80mm2.
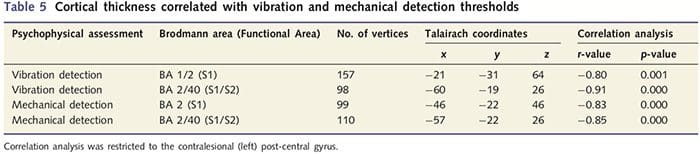
Como os pacientes exibiram déficits significativos na função somatossensorial dentro do território do nervo seccionado, formulamos a hipótese de que as medidas da função somatossensorial (vibração e detecção de toque) se correlacionariam com a espessura cortical no giro pós-central contralesional (córtex somatosensorial primário e secundário). Portanto, realizamos análises de correlação no grupo de pacientes entre: (i) espessura cortical e limiar de detecção de vibração; e (ii) espessura cortical e limiares de detecção de toque. Um paciente não completou a avaliação psicofísica; portanto, esta análise incluiu 13 pacientes com PNIr. Além disso, para determinar se havia relação entre a espessura cortical e o tempo de recuperação, também foi realizada uma análise de correlação entre essas duas medidas. Essas análises de correlação foram restritas ao giro pós-central contralesional, incluindo uma máscara (tirada do atlas de Freesurfer) no modelo linear geral. Foi realizada uma simulação de Monte Carlo restrita ao número de vértices dentro do giro pós-central contralesional; as imagens são exibidas com um P50.05 corrigido (derivado de um P50.0075 não corrigido e 68 vértices contíguos).
Análise de imagens do tensor de difusão
O processamento da imagem do tensor de difusão foi realizado com DTiStudio (www.MriStudio.org) e FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). As imagens foram primeiro realinhadas com a ferramenta Automatic Image Registration implementada no DTiStudio, usando a primeira imagem B0 da primeira série adquirida como modelo. Este processo corrige o movimento do assunto e a distorção por corrente parasita. Todas as imagens foram inspecionadas visualmente para avaliar a qualidade da imagem e o alinhamento das execuções de imagens de tensor de difusão separadas. Se um artefato foi detectado, a fatia foi removida antes de calcular a média das duas execuções de imagens de tensor de difusão separadas. Mapas FA individuais foram calculados usando a ferramenta DTIFIT implementada no FSL. A análise estatística baseada em voxel foi realizada para identificar diferenças de grupo na anisotropia fracionada média usando Tract Based Spatial Statistics; para uma descrição completa desses métodos, ver Smith et al. (2006). Resumidamente, as imagens foram registradas de forma não linear para uma imagem alvo (MNI152), a imagem média foi então criada a partir de todos os conjuntos de dados e esta imagem foi posteriormente afinada para representar todos os tratos que eram comuns a todos os sujeitos. Os valores mais altos de anisotropia fracionária de cada sujeito foram então projetados no esqueleto pesquisando na matéria branca perpendicular a cada ponto no esqueleto da matéria branca. Uma análise estatística baseada em voxel de todo o cérebro foi então realizada entre os grupos (14PNIr e 14 controles saudáveis) e as imagens foram corrigidas de todo o cérebro em P50.05. Além disso, uma análise de região de interesse foi realizada na substância branca folhetos adjacente ao S1 contralateral, tálamo e ínsula anterior e posterior bilateral. Essas regiões foram escolhidas por terem sido previamente implicadas em aspectos de somatossensibilização e por corresponderem às regiões que foram identificadas nas análises do fMRI e da análise da espessura cortical (ATC). As regiões de interesse foram desenhadas no esqueleto da substância branca da seguinte maneira: (i) A região contralateral S1 de interesse se originou medialmente na junção entre o esqueleto da matéria branca da coroa-radiata e a seção do esqueleto que se alimentava no giro pós-central; terminando no final do trato dentro de uma determinada fatia.
Na direção z, a região de interesse estendeu-se de z = 49 a 57; tratos de matéria branca suprindo a região da mão. (ii) A região do tálamo contralateral de interesse foi restrita a faixas de substância branca ao redor dos núcleos talâmicos posterior e medial (núcleos envolvidos na função somatossensorial), estendendo-se de z = 1 a 4. (iii) As regiões insulares de interesse foram desenhadas bilateralmente dentro substância branca adjacente à ínsula anterior e posterior com base em critérios publicados anteriormente por nosso laboratório (Taylor et al., 2008b). A região de interesse se estendeu de z = 2 a 8. Os valores de anisotropia fracionária foram extraídos de cada uma dessas regiões de interesse e uma análise de variância multivariada (MANOVA) foi realizada usando o Statistical Package for the Social Sciences v13.0 (SPSS Inc, Chicago), que incluiu valores de anisotropia fracionária para todas as seis regiões de interesse.
Resultados
A Tabela 1 fornece detalhes demográficos dos participantes do estudo. Todos os 14 pacientes sustentaram uma transecção completa do nervo mediano e / ou ulnar direito seguido por reparo microcirúrgico pelo menos 1.5 anos antes da inscrição no estudo. O tempo entre a cirurgia e o teste variou de 1.5 a 8 anos com uma média (? DP) de 4.8? 3 anos. Pacientes e controles não (34 ± 10 anos em ambos os grupos; t = 0.04; P = 0.97).
Psicofísica
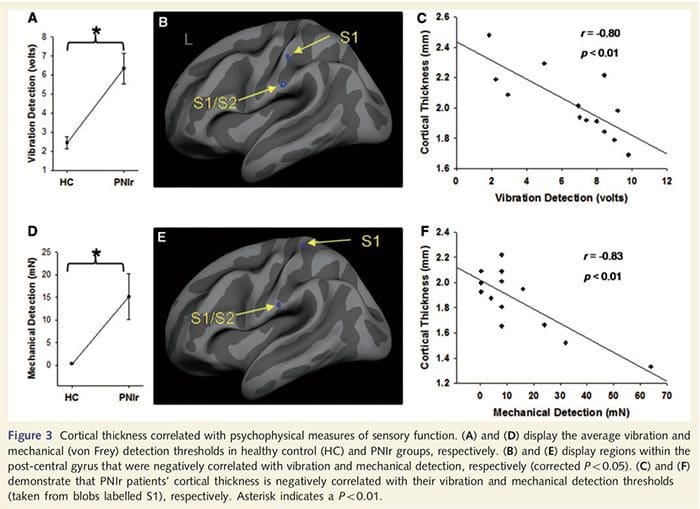
Os limiares de vibração foram calculados a partir de todas as três medições, uma vez que a análise de variância de medidas repetidas unidirecional (ANOVA) não indicou diferenças significativas entre as três tentativas [F (25, 1) = 0.227, P = 0.64]. Os limiares de vibração e detecção mecânica foram significativamente prejudicados em pacientes com PNIr em comparação com controles saudáveis (vibração: t = 4.77, P50.001, Fig. 3A; mecânica: t = 3.10, P = 0.005, Fig. 3D).
Teste de condução nervosa
As medidas de amplitude e latência obtidas dos nervos contralesionais de cada paciente foram classificadas como normais por um neurologista experiente do Toronto Western Hospital EMG Clinic. Nove dos 14 pacientes completaram o teste de condução nervosa. A Tabela 2 exibe os dados de latência e amplitude de aumento / diminuição médios para a condução nervosa sensorial do punho para os músculos abdutor curto do polegar (mediana) ou abdutor do dedo mínimo (ulnar) e para a condução sensorial do punho para D2 (mediana) e D5 ( ulnar) em comparação com o nervo contralesional não lesado de cada paciente. De nove, sete pacientes tiveram transecções que incluíram o nervo mediano. Destes sete, um paciente não teve resposta detectável durante o teste motor e outro paciente não teve resposta detectável durante o teste sensorial.
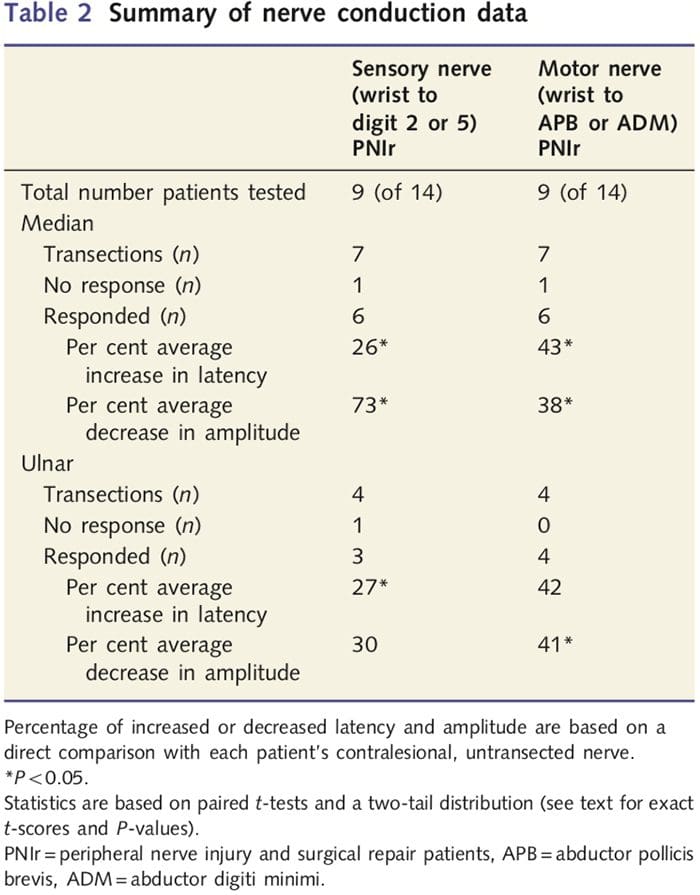 Nos seis pacientes com respostas detectáveis, as latências de condução motora aumentaram 43% (t = 6.2; P = 0.002) e as amplitudes diminuíram 38% (t = 2.6; P = 0.045) quando o nervo seccionado de cada paciente foi em comparação com seu lado não ferido. A condução sensorial nos nervos medianos também revelou um aumento de 26% na latência (t = 3.9; P = 0.011) e uma diminuição de 73% na amplitude (t = 8.0; P = 0.000) em comparação com os nervos contralesionais normais. Nos quatro pacientes com transecções do nervo ulnar, um paciente não teve resposta detectável durante o teste do nervo sensorial. Naqueles pacientes com respostas, as latências motoras do nervo ulnar não foram significativamente elevadas (t = 2.8; P = 0.070); no entanto, as amplitudes foram significativamente
Nos seis pacientes com respostas detectáveis, as latências de condução motora aumentaram 43% (t = 6.2; P = 0.002) e as amplitudes diminuíram 38% (t = 2.6; P = 0.045) quando o nervo seccionado de cada paciente foi em comparação com seu lado não ferido. A condução sensorial nos nervos medianos também revelou um aumento de 26% na latência (t = 3.9; P = 0.011) e uma diminuição de 73% na amplitude (t = 8.0; P = 0.000) em comparação com os nervos contralesionais normais. Nos quatro pacientes com transecções do nervo ulnar, um paciente não teve resposta detectável durante o teste do nervo sensorial. Naqueles pacientes com respostas, as latências motoras do nervo ulnar não foram significativamente elevadas (t = 2.8; P = 0.070); no entanto, as amplitudes foram significativamente
diminuiu em 41% (t = 5.9; P = 0.010). O teste sensorial do nervo ulnar demonstrou um aumento de 27% na latência (t = 4.3; P = 0.049), mas nenhum aumento significativo na amplitude (t =? 3.5; P = 0.072).
Plasticidade Funcional no Córtex Somatosensorial Primário
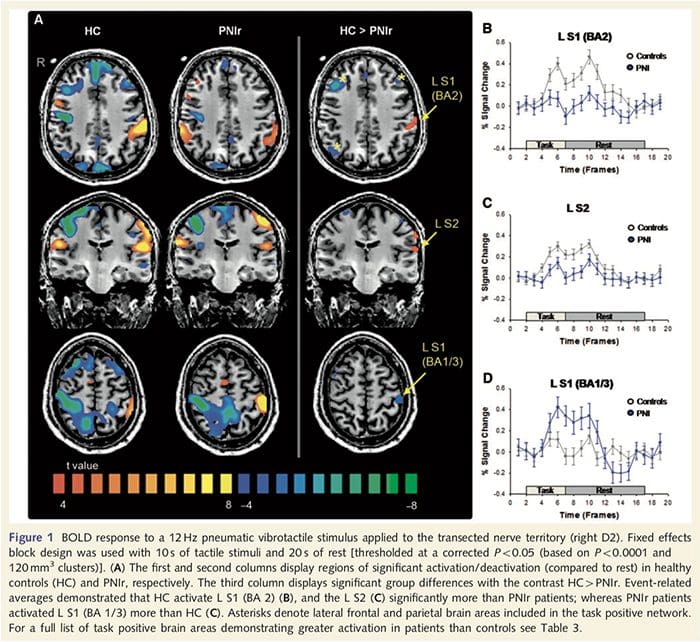
Mapas funcionais de ressonância magnética foram calculados a partir de 11 pacientes PNIr com transecções do nervo mediano direito (pacientes com transecções do nervo ulnar foram excluídos desta análise) e 11 controles saudáveis pareados por idade e sexo. Da Fig. 1A, é claro que os pacientes com PNIr têm significativamente menos ativação, em comparação com controles saudáveis, em uma região de S1 correspondente à área 2 de Brodmann (BA2) (Talairach e Tournoux, 1988) e S2 (ver Tabela 3 para detalhes) . As respostas médias relacionadas a eventos dessas regiões de interesse destacam a resposta BOLD atenuada no BA2 esquerdo e S2 esquerdo do paciente (Fig. 1B e C, respectivamente). Curiosamente, a estimulação vibrotátil nos pacientes ativou uma parte mais superior do giro pós-central (provavelmente BA1 / 3) (Talairach e Tournoux, 1988) (Fig. 1A e Tabela 3). Uma média relacionada a eventos (Fig. 1D) demonstra que controles saudáveis tiveram ativação mínima nesta região. Além disso, os pacientes tiveram significativamente mais ativação nas regiões do cérebro conhecidas coletivamente como a rede positiva da tarefa (asteriscos na Fig. 1). Consulte a Tabela 3 para obter a lista completa de áreas cerebrais positivas para a tarefa ativadas. Essa rede inclui os córtices pré-frontal lateral, parietal lateral, pré-motor e temporal inferior (Tabela 3): áreas do cérebro que são ativadas durante o desempenho de uma tarefa que exige atenção e suprimidas ou inativas durante o repouso ou tarefas que não são cognitivamente ou atenciosamente desafiadoras (Fox et al., 2005; DeLuca et al., 2006; Seminowicz e Davis 2007).
Matéria Cinzenta Reduzida no Córtex Somatosensorial Primário Correlaciona com Recuperação Sensorial
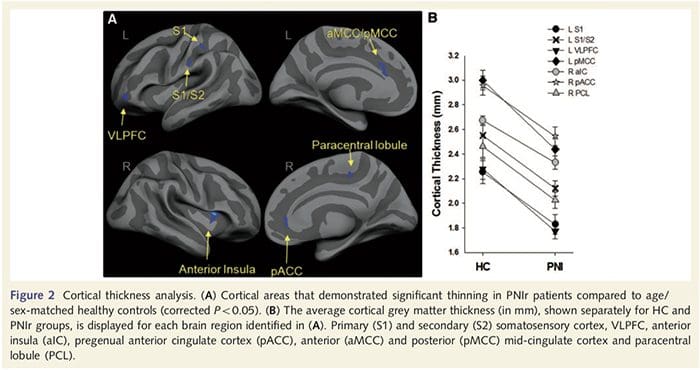
A análise da espessura cortical em todos os 14 pacientes e 14 controles saudáveis pareados por idade / sexo revelou vários loci de afinamento cortical significativo no grupo PNIr (Fig. 2 e Tabela 4). Especificamente, os pacientes tiveram uma redução de 13% 22% na espessura cortical no S1, S2 esquerdo (contralesional), giro cingulado anterior pré-renal, córtex pré-frontal ventrolateral e ínsula anterior direita, giro cingulado médio anterior / posterior e lóbulo paracentral. Curiosamente, os locais de afinamento da massa cinzenta dentro do giro pós-central coincidem com as regiões de BOLD reduzido após estimulação vibrotátil (Tabela 4). Uma vez que tínhamos conhecimento prévio dos déficits sensoriais dos pacientes e do tempo de recuperação (ou seja, tempo desde o reparo microcirúrgico), perguntamos a seguir se a espessura cortical do paciente no giro pós-central se correlacionava com seus limiares de detecção sensorial mecânica e de vibração, ou com seus tempo de recuperação. Essas análises revelaram uma correlação negativa entre a espessura cortical e os limiares de detecção de vibração em uma região que abrange BA1 / 2 e S2 (P50.001, r =? 0.80 e? 0.91, para BA1 / 2 e S2, respectivamente; Fig. 3 e Tabela 5 ) Além disso, os limiares de detecção mecânica também foram negativamente correlacionados com a espessura cortical em uma região BA2 ligeiramente mais superior e na mesma região S2 (P50.001, r =? 0.83 e? 0.85, para BA2 e S2, respectivamente; Fig. 3 e Tabela 5). No entanto, não identificamos uma relação significativa entre o tempo de recuperação e a espessura cortical. Portanto, no giro pós-central, o afinamento cortical foi associado a déficits sensoriais mais graves. No entanto, não identificamos uma relação significativa entre o tempo de recuperação e a espessura cortical. Novamente, houve uma correspondência entre o afinamento cortical em áreas negativamente correlacionadas com estímulos vibratórios e as regiões que mostram anormalidades de grupo fMRI e CTA.
Anormalidades da Matéria Branca Após Transecção do Nervo
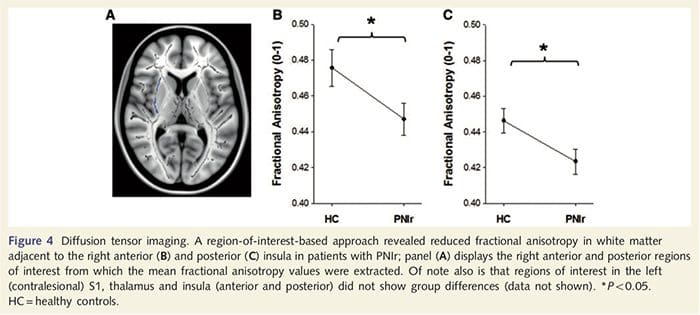
Para avaliar a integridade da substância branca, utilizamos uma abordagem de região de interesse para examinar diferenças de grupos de substância branca com base em hipóteses a priori. As regiões de interesse estavam restritas a trechos de substância branca que circundavam e alimentavam o S1 e o tálamo contralesional. Além disso, também desenhamos regiões de interesse na substância branca adjacente à ínsula anterior e posterior esquerda e direita. A ínsula foi escolhida por estar implicada no processamento somatossensorial e porque identificamos redução da substância cinzenta no insular anterior direito com ATC. Esta abordagem de região de interesse revelou que os pacientes apresentaram valores de anisotropia fracionada de substância branca significativamente reduzidos (MANOVA incluindo todas as seis regiões de interesse) adjacentes à anterior direita [F (1, 26) = 4.39, P = 0.046; Fig. 4A] e ínsula posterior [F (1, 26) = 5.55, P = 0.026; Fig. 4B], mas não houve diferenças de grupo na substância branca adjacente à ínsula esquerda (ínsula anterior esquerda: P = 0.51; ínsula posterior esquerda: P = 0.26), tálamo (P = 0.46) ou S1 (P = 0.46 ).
 Discussão
Discussão
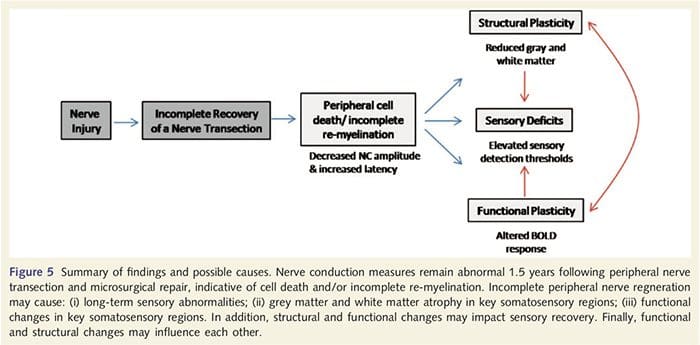
Aqui, demonstramos pela primeira vez que há plasticidade funcional e anormalidades estruturais da substância cinzenta e branca em várias áreas corticais após transecção do nervo periférico do membro superior e reparo cirúrgico. Essa plasticidade pode surgir da regeneração incompleta do nervo periférico (morte celular periférica e / ou re-mielinização incompleta), pois as medidas de condução nervosa nesses pacientes demonstraram anormalidades graves. Além disso, nossos dados demonstram que as respostas diminuídas de fMRI evocadas por vibrotáteis no giro pós-central correspondem à diminuição da massa cinzenta no grupo de pacientes. Estes resultados sugerem que respostas BOLD reduzidas podem ser facilitadas por uma redução na massa cinzenta cortical e / ou uma diminuição na entrada aferente para o giro pós-central. Além disso, a espessura cortical dentro dessas mesmas partes do giro pós-central correlacionou-se negativamente com medidas comportamentais da função somatossensorial. Ou seja, déficits somatossensoriais aumentados foram correlacionados com o córtex mais fino; ambos podem estar relacionados à entrada aferente. Em conjunto, nossos dados sugerem que a regeneração incompleta do nervo periférico contribui para prejuízos somatossensitivos, atrofia da substância cinzenta cortical e ativação reduzida da fMRI (veja a Figura 5 para um resumo desses achados).
É bem conhecido que a plasticidade cortical após transecção do nervo periférico e reparação cirúrgica pode ocorrer em todo o SNC em primatas não humanos (Kaas, 1991). Acredita-se que essa plasticidade seja devida ao desmascaramento de sinapses anteriormente silenciosas ou brotamento axonal em território desapropriado (Wall et al., 1986; Florence e Kaas, 1995). No modelo primata, 1 ano após a transecção do nervo e reparo cirúrgico, o córtex desnervado é caracterizado por representações incompletas e desordenadas dos nervos regenerados e adjacentes (intactos). Essa representação irregular é atribuída à regeneração periférica incompleta, resultando em uma recuperação parcial do espaço cortical desnervado (Kaas, 1991). Para avaliar a extensão da regeneração periférica em nossa população de pacientes, realizamos estudos de condução nervosa sensorial e motora em toda a área transectada. Nossos resultados de condução nervosa demonstram que os pacientes com PNI têm uma diminuição significativa da amplitude e aumento da latência em ambos os nervos sensoriais e motores, em comparação com o seu próprio lado não transfetado. A diminuição da amplitude combinada com o aumento da latência é indicativa de perda de fibras periféricas (isto é, morte celular) e / ou re-mielinização anormal ou incompleta após a transecção (Kimura, 1984). Além disso, está bem estabelecido que entre os neurónios 20% e 50% do gânglio da raiz dorsal morrem após a transecção do nervo (Liss et al., 1996). Assim, a morte celular aferente e a regeneração incompleta podem resultar em diminuição da entrada aferente no córtex, o que pode ser responsável por déficits sensoriais contínuos e diminuição da resposta BOLD em BA2 e S2. Além disso, esse input aferente diminuído também poderia explicar o afinamento cortical que observamos nas mesmas regiões do córtex. Foi demonstrado que a privação sensorial causa degeneração trans neuronal em várias regiões do SNC, incluindo o corno dorsal após a secção do nervo ciático (Knyihar-Csillik et al., 1989) e pode envolver neurônios de segunda e terceira ordem (Powell e Erulkar, 1962). A degeneração transneuronal é caracterizada por encolhimento celular e acredita-se que esteja relacionada à entrada aferente diminuída ou inexistente (Knyihar-Csillik et al., 1989). Assim, a perda de matéria cinzenta cortical (ou atrofia) também pode estar diretamente relacionada à diminuição do input aferente.
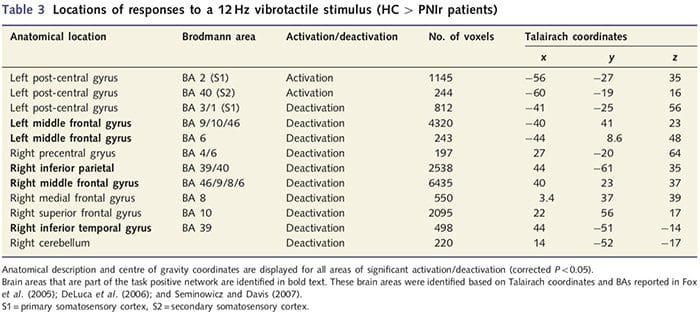
 Também demonstramos uma ativação aumentada no giro pós-central em uma região correspondente a BA1 / 3 (Talairach e Tournoux, 1988). Estudos eletrofisiológicos, de traçados anatômicos e de neuroimagem determinaram que, para a maioria dos aferentes mecanoreceptores cutâneos, as primeiras destinações corticais são BA1 e BA3b. Cada área do cérebro citoarquitetônico possui um mapa corporal somatotópico com pequenos campos receptivos. Além disso, essas áreas respondem a muitas características da informação tátil, como textura e rugosidade, velocidade e curvatura dos estímulos (Bodegard et al., 2001). Estudos de RMf demonstraram que a atividade dentro do córtex somatossensorial é influenciada pela atenção, de modo que as respostas da RMf aos estímulos táteis em S1 aumentam quando os sujeitos assistem a um estímulo tátil, mas são atenuados quando os indivíduos estão distraídos (Arthurs et al. 2004; Porro et al., 2004). Além disso, nossos pacientes ativaram uma rede de áreas cerebrais conhecidas como rede positiva de tarefa (DeLuca et al., 2006) mais do que controles saudáveis. Essas áreas cerebrais são ativadas durante processos que exigem atenção (Fox et al., 2005; Seminowicz e Davis, 2007). Juntos, esses achados implicam que os pacientes devem atender ao estímulo mais do que os controles por causa de sua entrada sensorial prejudicada. Esta atenção aumentada também pode ser responsável pelo aumento da ativação no BA1 / 3b. Naturalmente, o aumento da ativação em BA1 / 3b também pode refletir a plasticidade que não está relacionada à carga atencional.
Também demonstramos uma ativação aumentada no giro pós-central em uma região correspondente a BA1 / 3 (Talairach e Tournoux, 1988). Estudos eletrofisiológicos, de traçados anatômicos e de neuroimagem determinaram que, para a maioria dos aferentes mecanoreceptores cutâneos, as primeiras destinações corticais são BA1 e BA3b. Cada área do cérebro citoarquitetônico possui um mapa corporal somatotópico com pequenos campos receptivos. Além disso, essas áreas respondem a muitas características da informação tátil, como textura e rugosidade, velocidade e curvatura dos estímulos (Bodegard et al., 2001). Estudos de RMf demonstraram que a atividade dentro do córtex somatossensorial é influenciada pela atenção, de modo que as respostas da RMf aos estímulos táteis em S1 aumentam quando os sujeitos assistem a um estímulo tátil, mas são atenuados quando os indivíduos estão distraídos (Arthurs et al. 2004; Porro et al., 2004). Além disso, nossos pacientes ativaram uma rede de áreas cerebrais conhecidas como rede positiva de tarefa (DeLuca et al., 2006) mais do que controles saudáveis. Essas áreas cerebrais são ativadas durante processos que exigem atenção (Fox et al., 2005; Seminowicz e Davis, 2007). Juntos, esses achados implicam que os pacientes devem atender ao estímulo mais do que os controles por causa de sua entrada sensorial prejudicada. Esta atenção aumentada também pode ser responsável pelo aumento da ativação no BA1 / 3b. Naturalmente, o aumento da ativação em BA1 / 3b também pode refletir a plasticidade que não está relacionada à carga atencional.
 BA2 e S2 recebem projeções de BA1 / 3b e também de partes distintas do complexo talâmico ventroposterior (Pons et al., 1985; Friedman e Murray, 1986). Ambos estes cérebro as áreas têm campos receptivos grandes, frequentemente com vários dígitos (BA2) ou bilaterais (S2) (Pons et al., 1985; Iwamura et al., 2002). Com base em projeções anatômicas e propriedades de resposta neuronal, o processamento hierárquico da informação tátil foi demonstrado de BA1 / 3b a BA 2 (Kaas et al., 2002). Além disso, estudos eletrofisiológicos em macacos (Pons et al., 1987) e dados de magnetoencefalografia adquiridos em humanos sugerem que o processamento serial de entradas táteis ocorre de S1 a S2 em primatas superiores (Frot e Mauguiere 1999; Disbrow et al. ., 2001). Vários estudos demonstraram que BA2 é preferencialmente ativado pela forma e curvatura (Bodegard et al., 2001), enquanto S2 pode estar envolvido na aprendizagem tátil (Ridley e Ettlinger 1976; Murray e Mishkin, 1984), apoiando a noção de que essas áreas do cérebro estão envolvidos no processamento somatossensorial de ordem superior. Nossa avaliação psicofísica demonstrou que os pacientes estavam significativamente prejudicados na detecção de estímulos táteis simples e no teste de Identificação da Textura da Forma 1.5 anos após a cirurgia (Taylor et al., 2008a). Este último teste avalia a capacidade do paciente de reconhecer as características de um objeto enquanto explora ativamente uma forma ou textura, exigindo a integração de informações sensoriais em todas as regiões do corpo (Rosen e Lundborg, 1998). Tomados em conjunto, uma interpretação de nossos dados é que os pacientes com RNP prestam mais atenção ao estímulo vibrotátil, levando ao aumento da ativação da rede positiva da tarefa e BA1 / 3. No entanto, nesses pacientes, nossos dados sugerem que áreas de processamento de ordem superior, como BA2 e S2, não receberam informações táteis, o que, por sua vez, pode resultar em afinamento cortical e respostas BOLD reduzidas.
BA2 e S2 recebem projeções de BA1 / 3b e também de partes distintas do complexo talâmico ventroposterior (Pons et al., 1985; Friedman e Murray, 1986). Ambos estes cérebro as áreas têm campos receptivos grandes, frequentemente com vários dígitos (BA2) ou bilaterais (S2) (Pons et al., 1985; Iwamura et al., 2002). Com base em projeções anatômicas e propriedades de resposta neuronal, o processamento hierárquico da informação tátil foi demonstrado de BA1 / 3b a BA 2 (Kaas et al., 2002). Além disso, estudos eletrofisiológicos em macacos (Pons et al., 1987) e dados de magnetoencefalografia adquiridos em humanos sugerem que o processamento serial de entradas táteis ocorre de S1 a S2 em primatas superiores (Frot e Mauguiere 1999; Disbrow et al. ., 2001). Vários estudos demonstraram que BA2 é preferencialmente ativado pela forma e curvatura (Bodegard et al., 2001), enquanto S2 pode estar envolvido na aprendizagem tátil (Ridley e Ettlinger 1976; Murray e Mishkin, 1984), apoiando a noção de que essas áreas do cérebro estão envolvidos no processamento somatossensorial de ordem superior. Nossa avaliação psicofísica demonstrou que os pacientes estavam significativamente prejudicados na detecção de estímulos táteis simples e no teste de Identificação da Textura da Forma 1.5 anos após a cirurgia (Taylor et al., 2008a). Este último teste avalia a capacidade do paciente de reconhecer as características de um objeto enquanto explora ativamente uma forma ou textura, exigindo a integração de informações sensoriais em todas as regiões do corpo (Rosen e Lundborg, 1998). Tomados em conjunto, uma interpretação de nossos dados é que os pacientes com RNP prestam mais atenção ao estímulo vibrotátil, levando ao aumento da ativação da rede positiva da tarefa e BA1 / 3. No entanto, nesses pacientes, nossos dados sugerem que áreas de processamento de ordem superior, como BA2 e S2, não receberam informações táteis, o que, por sua vez, pode resultar em afinamento cortical e respostas BOLD reduzidas.
Acredita-se que a ínsula desempenhe um papel na integração de informações multimodais importantes para as funções sensorimotora, emocional, alostática / homeostática e cognitiva (Devinsky et al., 1995; Critchley, 2004; Craig, 2008) e foi designada córtex sensitivo límbico (Craig , 2008). Vários estudos relataram ativação insular em resposta à estimulação tátil (Gelnar et al., 1998;
Downar et al., 2002) e estudos de traçados anatômicos em primatas demonstraram que a ínsula está reciprocamente conectada aos lobos frontal, parietal e temporal (Agostinho, 1996). Em nossos pacientes, a ínsula anterior direita foi a única área cortical que demonstrou afinamento cortical significativo em conjunto com valores reduzidos de anisotropia fracionada na substância branca adjacente, sugerindo que o afinamento cortical nessa região está associado a uma perda de fibras projetando-se para ou de esta estrutura. A ínsula anterior direita tem sido implicada na interocepção, pois está situada para integrar a entrada homeostática do corpo com condições motivacionais, emocionais e sociais (Craig, 2008). Além disso, Critchley et al. (2004) relatou uma correlação entre habilidades interoceptivas e o volume de massa cinzenta da ínsula anterior direita. Dada a nossa descoberta de que os pacientes diminuíram a massa cinzenta na ínsula anterior direita, seria interessante avaliar as capacidades interoceptivas após lesão nervosa periférica em um estudo futuro.
Em conjunto, demonstramos pela primeira vez que alterações funcionais e estruturais estão presentes no córtex cerebral humano 1.5 anos após uma transecção completa do nervo periférico do membro superior que foi microcirurgicamente reparado. Além disso, medidas de condução nervosa indicam regeneração periférica incompleta nesses pacientes. Além disso, mostramos que a espessura cortical está relacionada a medidas psicofísicas de recuperação, em que o córtex mais fino dentro de BA2 e S2 foi associado com pior função somatossensorial. Esses dados sugerem que o restabelecimento dos mapas de ativação funcional normal está diretamente associado à regeneração bem-sucedida dos aferentes periféricos.
Keri S. Taylor, 1,2 Dimitri J. Anastakis 2,3,4 e Karen D. Davis1,2,3
1 Division of Brain, Imaging and Behavior Systems Neuroscience, Toronto Western Research Institute, University Health Network, Toronto, Canadá M5T258
2 Instituto de Ciências Médicas da Universidade de Toronto, Canadá
3 Departamento de Cirurgia da Universidade de Toronto, Canadá
Centro de Recursos de Estudos Clínicos 4, Instituto de Pesquisas do Oeste de Toronto, University Health Network, Toronto, Canadá M5T2S8
Correspondência para: Karen D. Davis, Ph.D.,
Divisão de Cérebro, Imagem e Comportamento Sistemas de Neurociência, Toronto Western Research Institute,
Toronto Western Hospital,
Rede de Saúde Universitária,
Sala MP14-306, 399 Bathurst Street,
Toronto, Ontario,
Canadá M5T 2S8
E-mail kdavis@uhnres.utoronto.ca
Agradecimentos
Os autores agradecem ao Sr. Geoff Pope, ao Dr. Adrian Crawley, ao Sr. Eugene Hlasny e ao Sr. Keith Ta pela assistência técnica especializada. Os autores gostariam de agradecer ao Dr. Peter Ashby e ao Sr. Freddy Paiz, da Clínica EMG do Western Hospital de Toronto, pela condução dos testes de condução nervosa e por fornecer avaliação especializada dos resultados. Os autores também agradecem aos Drs Dvali, Binhammer, Fialkov e Antonyshyn por colaborarem com este projeto. Dr. Davis é uma Cátedra de Pesquisa em Cérebro e Comportamento do Canadá (CIHR MOP 53304).
Métodos
The Physicians Services Incorporated e uma bolsa inicial conjunta do Centro para o Estudo da Dor da Universidade de Toronto / AstraZeneca.
Material suplementar
Material suplementar está disponível no Brain on-line.
em branco
Referências:
Apkarian AV, Sosa Y, Sonty S, et al. Dor nas costas crônica está associada a
diminuição da densidade pré-frontal e talâmica da matéria cinzenta. J Neurosci
2004; 24: 10410 5.
Arthurs OJ, Johansen-Berg H, Matthews PM, Boniface SJ. Atenção
modula diferencialmente o acoplamento de fMRI BOLD e evocado
amplitudes potenciais do sinal no córtex somatossensorial humano 7.
Exp Brain Res 2004; 157: 269 74.
Augustine JR. Circuito e aspectos funcionais do lobo insular
em primatas, incluindo humanos. Brain Res Brain Res Rev 1996; 22:
229 44.
Beaulieu C. A base da difusão anisotrópica da água no sistema nervoso
sistema - uma revisão técnica. NMR Biomed 2002; 15: 435 55.
Bodegard A, Geyer S, Grefkes C, Zilles K, Roland PE. Hierárquico
processamento da forma tátil no cérebro humano. Neuron 2001; 31:
317 28.
Craig AD. Interocepção e emoção: uma perspectiva neuroanatômica.
In: Lewis M, Haviland-Jones J, Barrett L, editores. Manual de
emoções. Nova York: Guildford Press; 2008. p. 272 87.
Critchley HD. O córtex humano responde a um desafio interoceptivo.
Proc Natl Acad Sci USA 2004; 101: 6333 4.
Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Sistemas neurais
apoiar a consciência interoceptiva. Nat Neurosci 2004; 7: 189 95.
Dale AM, Fischl B, Sereno MI. Análise de superfície cortical. I. Segmentação
e reconstrução de superfície. Neuroimage 1999; 9: 179 94.
Davis KD, Pope G, Chen J, Kwan CL, Crawley AP, Diamant NE. Cortical
afinamento em IBS: implicações para homeostática, atenção e dor
em processamento. Neurology 2008; 70: 153 4.
DeLuca M, Beckmann CF, De SN, Matthews PM, Smith SM. fMRI em repouso
redes estaduais definem modos distintos de interações de longa distância
no cérebro humano. Neuroimage 2006; 29: 1359 67.
Devinsky O, Morrell MJ, Vogt BA. Contribuições do cíngulo anterior
córtex ao comportamento. Brain 1995; 118 (Pt 1): 279 306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Evidence for interhemispheric
processamento de entradas de mãos em humanos S2
e PV. J Neurophysiol 2001; 85: 2236 44.
Downar J, Crawley AP, Mikulis DJ, Davis KD. Uma rede cortical sensível
para estimular a saliência em um contexto comportamental neutro em vários
modalidades sensoriais. J Neurophysiology 2002; 87: 615 20.
Draganski B, Moser T., Lummel N., et al. Diminuição do cinza talâmico
assunto após a amputação do membro. Neuroimage 2006; 31: 951 7.
Fischl B, Dale AM. Medindo a espessura do córtex cerebral humano
a partir de imagens de ressonância magnética. Proc Natl Acad Sci USA 2000; 97:
11050 5.
Fischl B, Sereno MI, Dale AM. Análise de superfície cortical. II:
Inflação, achatamento e um sistema de coordenadas com base na superfície.
Neuroimage 1999a; 9: 195 207.
Fischl B, Sereno MI, Tootell RB, Dale AM. Intersubject de alta resolução
média e um sistema de coordenadas para a superfície cortical. Cérebro Hum
Mapp 1999b; 8: 272 84.
Florence SL, Kaas JH. Reorganização em grande escala em vários níveis do
via somatossensorial segue a amputação terapêutica da mão
em macacos. J Neurosci 1995; 15: 8083 95.
Fox MD, Snyder AZ, Vincent JL, Corbetta M, Van E, Raichle ME. o
o cérebro humano é intrinsecamente organizado em formas dinâmicas e anticorrelacionadas
redes funcionais. Proc Natl Acad Sci USA 2005; 102: 9673 9678.
Friedman DP, Murray EA. Conectividade talâmica do segundo
área somatossensorial e campos somatossensoriais vizinhos do
sulco lateral do macaco. J Comp Neurol 1986; 252: 348 73.
Frot M, Mauguiere F. Tempo e distribuição espacial do somatossensorial
respostas registradas na margem superior da fissura sylvian (área SII) em
humanos. Cereb Cortex 1999; 9: 854 63.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
O cérebro na dor crônica de CRPS: substância branca acinzentada anormal
interações em regiões emocionais e autonômicas. Neuron 2008; 60:
570 81.
Gelnar PA, Krauss BR, Szeverenyi NM, Apkarian AV. Representação da ponta do dedo
no córtex somatossensorial humano: um estudo de fMRI.
Neuroimage 1998; 7: 261 83.
Hickmott PW, Steen PA. Mudanças em grande escala na estrutura dendrítica
durante a reorganização do córtex somatossensorial adulto. Nat Neurosci
2005; 8: 140 42.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T. Processamento de
sinais táteis e cinestésicos de lados bilaterais do corpo no
giro pós-central de macacos acordados. Behav Brain Res 2002; 135:
185 90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Lesões dos nervos mediano, ulnar e combinado mediano-ulnar: funcionais
resultado e retorno à produtividade. J Trauma 2001; 51: 687 92.
Jurkiewicz MT, Crawley AP, Verrier MC, Fehlings MG, Mikulis DJ.
Atrofia cortical somatossensorial após lesão da medula espinhal: um voxel baseado
estudo morfométrico. Neurology 2006; 66: 762 4.
Kaas JH. Plasticidade dos mapas sensoriais e motores em mamíferos adultos. Annu
Rev Neurosci 1991; 14: 137 67.
Kaas JH, Jain N, Qi HX. A organização do sistema somatossensorial em
primatas. In: Nelson RJ, editor. O sistema somatossensorial.
Washington, DC: CRC Press; 2002. p. 1 25.
Kimura J. Eletrodiagnóstico em doenças do nervo e músculo: princípios
e pratique. Oxford: Oxford University Press; 2001.
Kimura J. Princípios e armadilhas dos estudos de condução nervosa. Ann Neurol
1984; 16: 415 29.
Knyihar-Csillik E, Rakic P, Csillik B. Degeneração transneuronal em
a substância Rolando da medula espinhal dos primatas evocada por
atrofia degenerativa transganglionar induzida por axotomia da
terminais sensoriais primários. Cell Tissue Res 1989; 258: 515 25.
Liss AG, af Ekenstam FW, Wiberg M. Perda de neurônios na raiz dorsal
gânglios após a transecção de um nervo sensorial periférico. Um anatômico
estudo em macacos. Scand J Plast Reconstr Surg Hand Surg 1996; 30: 1 6.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. movimentos fantasmas
e dor. Um estudo de fMRI em amputados de membros superiores. Brain 2001;
124: 2268 77.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. Serial
fMRI de mudanças adaptativas no córtex sensório-motor primário após
reconstrução do polegar. Neurology 2002; 59: 1278 81.
Maio A. A dor crônica pode alterar a estrutura do cérebro. Pain 2008;
137: 7 15.
McAllister RM, Gilbert SE, Calder JS, Smith PJ. A epidemiologia e
gestão de lesões de nervos periféricos do membro superior em
prática. J Hand Surg (Br) 1996; 21: 4 13.
Murray EA, Mishkin M. Contribuições relativas de SII e area5 para tátil
Discriminação em macacos 2. Behav Brain Res 1984; 11: 67 83.
Napadow V, Kettner N, Ryan A, Kwong KK, Audette J, Hui KK.
Plasticidade cortical somatossensorial na síndrome do túnel do carpo - um corte transversal
avaliação fMRI. Neuroimage 2006; 31: 520 30.
Oldfield RC. A avaliação e análise da lateralidade: o Edinburgh
inventário. Neuropsychologia 1971; 9: 97 113.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. A organização somatotópica
da área 2 em macacos macacos 6. J Comp Neurol 1985; 241: 445 66.
Pons TP, Garraghty PE, Friedman DP, Mishkin M. Provas fisiológicas
para processamento serial no córtex somatossensorial. Science 1987; 237:
417 20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Percept-related activity
no sistema somatossensorial humano: ressonância magnética funcional
estudos de imagem. Magn Reson Imaging 2004; 22: 1539 48.
Powell TP, Erulkar S. Transneuronal cell degeneration in the auditory
núcleos de retransmissão do gato. J Anat 1962; 96: 249 68.
Ridley RM, Ettlinger G. Aprendizagem tátil prejudicada e retenção após
remoções do segundo córtex de projeção sensorial somática (SII) no
macaco. Brain Res 1976; 109: 656 60.
Rosen B, Lundborg G. Um novo instrumento de gnose tátil na sensibilidade
testando. J Hand Ther 1998; 11: 251 7.
Seminowicz DA, Davis KD. A dor melhora a conectividade funcional
de uma rede cerebral evocada pelo desempenho de uma tarefa cognitiva.
J Neurophysiol 2007; 97: 3651 9.
Smith SM, Jenkinson M, Johansen-Berg H, et al. Espacial baseado em tratos
estatística: análise voxelwise de dados de difusão de múltiplos sujeitos.
Neuroimage 2006; 31: 1487 1505.
Talairach J, Tournoux P. Co-planar stereotaxic atlas of the human brain.
Nova York: Thieme Medical Publishers Inc .; 1988.
Taylor KS, Anastakis DJ, Davis KD. Dor crônica após periferia
a lesão do nervo está associada à catastrofização da dor e ao neuroticismo.
Int Ass Stud Pain 2008a; 267.
Taylor KS, Davis KD. Estabilidade de fMRI tátil e relacionada à dor
ativações cerebrais: um exame de dependentes do limiar e
métodos independentes de limiar. Hum Brain Mapp 2009; 30:
1947 62.
Taylor KS, Seminowicz DA, Davis KD. Dois sistemas de estado de repouso
conectividade entre a ínsula e o córtex cingulado. Cérebro Hum
Mapp 2008b; DOI: 10.1002 / hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, Felleman DJ, Merzenich MM.
Reorganização funcional nas áreas corticais somatossensoriais 3b e 1
de macacos adultos após reparo do nervo mediano: possível relação com
recuperação sensorial em humanos. J Neurosci 1986; 6: 218 33.
Acordeão próximo
Escopo de prática profissional *
As informações aqui contidas em "Cortando seu nervo muda seu cérebro | El Paso, TX." não se destina a substituir um relacionamento individual com um profissional de saúde qualificado ou médico licenciado e não é um conselho médico. Incentivamos você a tomar decisões de saúde com base em sua pesquisa e parceria com um profissional de saúde qualificado.
Informações do blog e discussões de escopo
Nosso escopo de informações limita-se à Quiropraxia, musculoesquelética, medicamentos físicos, bem-estar, contribuindo distúrbios viscerossomáticos dentro de apresentações clínicas, dinâmica clínica de reflexo somatovisceral associada, complexos de subluxação, questões de saúde sensíveis e/ou artigos, tópicos e discussões de medicina funcional.
Nós fornecemos e apresentamos colaboração clínica com especialistas de várias disciplinas. Cada especialista é regido por seu escopo profissional de prática e sua jurisdição de licenciamento. Usamos protocolos funcionais de saúde e bem-estar para tratar e apoiar o cuidado de lesões ou distúrbios do sistema músculo-esquelético.
Nossos vídeos, postagens, tópicos, assuntos e insights abrangem assuntos clínicos, problemas e tópicos relacionados e apoiam direta ou indiretamente nosso escopo de prática clínica.*
Nosso escritório tentou razoavelmente fornecer citações de apoio e identificou o estudo de pesquisa relevante ou estudos que apóiam nossas postagens. Fornecemos cópias dos estudos de pesquisa de apoio à disposição dos conselhos regulatórios e do público mediante solicitação.
Entendemos que cobrimos questões que requerem uma explicação adicional de como isso pode ajudar em um plano de cuidados ou protocolo de tratamento específico; portanto, para discutir melhor o assunto acima, sinta-se à vontade para perguntar Dr. Alex Jiménez, DC, ou contacte-nos 915-850-0900.
Estamos aqui para ajudar você e sua família.
Bênçãos
Dr. Alex Jimenez DC MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
o email: coach@elpasofunctionalmedicine. com
Licenciado como Doutor em Quiropraxia (DC) em Texas & Novo México*
Licença DC do Texas # TX5807, Novo México DC Licença # NM-DC2182
Licenciada como enfermeira registrada (RN*) in Florida
Licença da Flórida Licença RN # RN9617241 (Controle nº 3558029)
Status compacto: Licença Multiestadual: Autorizado para exercer em Estados 40*
Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Meu cartão de visita digital